北京时间2021年12月16日23时,我所薛婧团队与中国医学科学院病原生物学研究所何玉先团队合作,在《细胞》(Cell)上发表研究论文“Efficient treatment and pre-exposure prophylaxis in rhesus macaques by an HIV fusion-inhibitory lipopeptide”。


作者使用了艾滋病潜伏感染恒河猴模型(资源标识符CSTR:16397.09.0G16000448),设计了具有极高抗HIV活性且长效的脂肽病毒融合抑制剂,通过恒河猴模型研究发现,低剂量单药治疗能够有效抑制SHIV (一种HIV和SIV嵌合病毒)病毒复制,且维持长期有效的治疗效果。更有意义的是,他们发现部分恒河猴停药后能实现病毒稳定控制。深入研究发现,病毒稳定控制猴的病毒DNA以低水平隐藏于深部淋巴结,具有更少的活病毒产生和PD-1+中心记忆CD4+ T细胞;与之相反,停药后病毒反弹猴的病毒DNA以较高水平聚集在浅表淋巴结。研究还证明了CD8+ T细胞对停药后病毒控制结局起到了关键作用。此外,他们发现新型抑制剂在恒河猴预防给药可有效阻断SHIV和SIV(猴免疫缺陷病毒)经过直肠、阴道或静脉途径的感染,因此可作为暴露前预防(PrEP)的新策略。
众所周知,艾滋病严重影响人类健康和社会经济发展,但目前既无有效的预防疫苗,也无可以根治病毒感染的药物。高效抗逆转录病毒疗法(HAART方案)能够有效地抑制HIV复制,将病毒载量降至血液中检测不到的水平,但由于病毒潜伏库的存在,停药后HIV会迅速反弹。同时因为长期服药,患者也面临药物毒性积累和病毒变异耐药等问题。因此,研究新的艾滋病长效治疗和预防方法是当前重大科学问题,也是研究的难点,而探明病毒潜伏库特征和阻断策略则是研究治疗与预防方法的关键。
实现“停药后稳定的病毒控制”,即功能性治愈,是现阶段艾滋病防治领域的理想目标。 “柏林病人”和“伦敦病人”是国际上仅有的被认为成功治愈的艾滋病患者,燃起了人们对治愈研究的希望和治愈策略的探索。近期,“旧金山患者”、“埃斯佩兰萨患者”作为未经治疗而实现清除性治愈的病例,再次引起广泛关注。此外,以“阿根廷病人”为代表的治疗后控制的一些病例(posttreatment controllers, PTC),他们可以在长期的抗病毒治疗停药后,较长时间的维持稳定的HIV控制状态。这些病例的不断涌现,提示科学界需要深入探讨能够实现“稳定病毒控制”背后的病毒潜伏库和免疫调节机制。
研究HIV的潜伏机制、筛选功能性治愈药物,需要构建相应的动物模型。免疫系统健全的非人灵长类动物是造模最为理想的模式动物,适用于潜伏机制研究的动物模型需要精确模拟艾滋病感染、发病、药物治疗、病毒潜伏、停药后复发等各阶段,才能探索潜伏库的特征,研究宿主免疫的控制机制。
薛婧团队长期专注于艾滋病恒河猴模型,通过阐明与HIV类似的病毒SIV及嵌合病毒SHIV在恒河猴体内的复制、免疫互作、病毒潜伏的精细化特征,不断建立模型特异的新技术,筛选理想的病毒控制药物,从而改进和优化动物模型。经过近10年的努力,动物模型从最初急性感染模型,不断增加了慢性感染、治疗药物评价、长效药物控制后病毒潜伏、停药后反弹等阶段性特征,在为国内外研发机构HIV疫苗和药物受试物评价和试错的过程中不断完善,最终成为本次研究有利的一个工具,证明了LP-98是有效的HIV长效控制药物,而且能部分实现稳定病毒控制,也初步阐明了与停药后控制相关的病毒潜伏库特征及免疫机制。
何玉先教授团队多年来致力于新型HIV膜融合抑制剂的研发,通过反复筛选设计,经历无数次失败或挫折,才使LP-98的抗病毒活性提高到目前的皮摩尔(pM)水平。中间历经LP-11、LP-19、LP-40、LP-46、LP-52、LP-80、LP-83等渐进性优化提高阶段。最后,通过体外(in-vitro)、离体(ex-vivo)和体内(in-vivo)实验对候选脂肽的筛选,本论文获得两个具有极强抗HIV活性的脂肽病毒融合抑制剂(LP-97和LP-98)(图1)。作者发现LP-98在SHIV慢性感染恒河猴模型中具有长期稳定的治疗效果,该药物在体内可低剂量使用,且发挥长效作用。
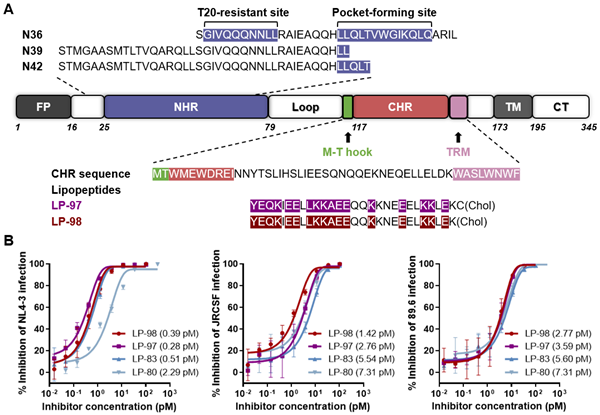

图1 HIV融合蛋白gp41结构及脂肽结构和抗病毒活性示意图
在治疗效果方面,该文中21只感染猴给予LP-98治疗并停药后,发现40%左右的治疗猴呈停药后稳定的病毒反弹状态(stable virologic rebound, SVR),30%左右的治疗猴呈停药后病毒不稳定反弹状态(unstable virologic rebound, UVR),而20%左右的治疗猴表现出最为理想的“停药后稳定的病毒控制”状态(stable virologic control, SVC)。通过对比三组治疗猴的病毒潜伏库特征,作者发现SVC猴的病毒潜伏库以较低水平隐藏于肠系膜、肠旁等深部淋巴结,SVR猴的潜伏库以较高水平的病毒DNA主要分布在颈部、腋窝等浅表淋巴结,UVR猴的潜伏库以中等水平的病毒DNA分布在浅表和深部淋巴结,提示病毒DNA的潜伏库部位和水平与停药后是否反弹相关(图2)。进一步研究证实,SVC猴的组织潜伏库具有更少产生活病毒的能力,且PD-1阳性的中心记忆CD4+ T细胞比例更低。
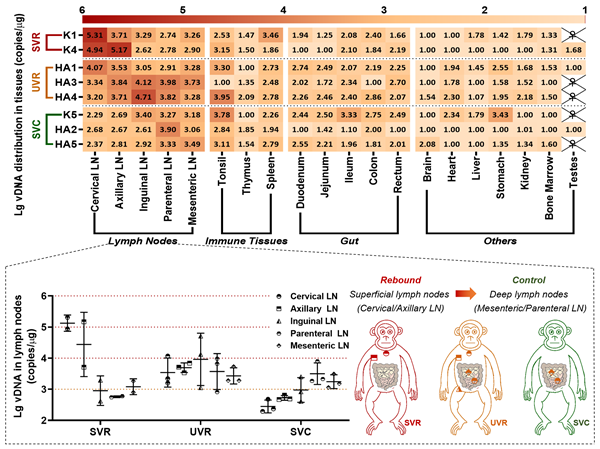

图2 LP-98治疗猴病毒潜伏库分布特征
为探讨停药后实现病毒控制或部分控制的机制,该文将SVC猴和UVR猴体内的CD8+ T细胞敲除后,病毒载量迅速反弹。通过比较三组治疗猴的病毒特异CD8+ T细胞应答,发现SVC猴的病毒特异性CD8+ T细胞反应更强、多功能CD8+ T细胞应答增加(图3)。进而,他们分选并获得三组治疗猴CD8+ T细胞,转录组测序发现三组差异基因富集在免疫应答相关通路。
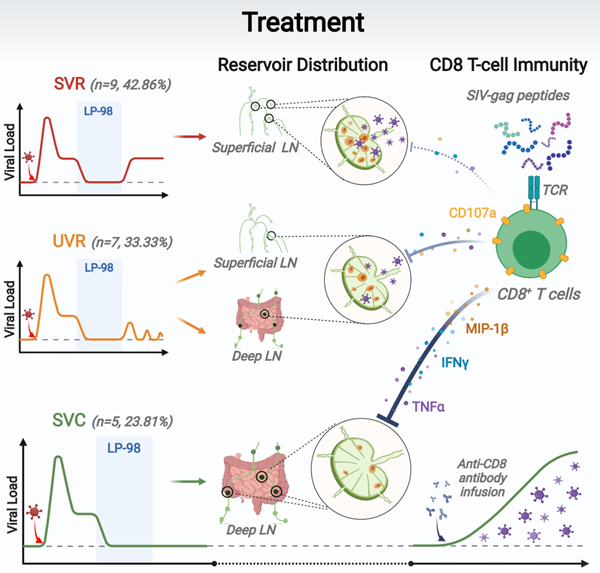

图3 LP-98在恒河猴模型的治疗效果及病毒潜伏库、免疫控制研究
该文还进行了LP-98的暴露前预防实验研究。首先,LP-98分别在SHIV静脉攻毒前2小时、1周、2周给药,与模型对照组相比,攻毒前2小时组和1周组恒河猴得到了完全保护,2周组无明显保护效果,从而确定了该药物可在1周内实现保护,提示暴露前预防用药的有效保护期为1周。进而,在1周给药1次,每周攻毒2次,持续攻毒达12次的直肠和阴道SHIV攻毒实验中,发现恒河猴可完全阻断SHIV病毒的感染,体内均未检测到病毒RNA、病毒DNA和特异性抗体。该研究还发现LP-98也可完全阻断SIV经直肠和阴道途径的攻击。为明确SIV的暴露前预防保护效果,6只经直肠途径完全保护的恒河猴,在首次攻毒150天后,随机选取3只进行二次攻毒,这3只恒河猴成功感染,而其余3只首次得到完全保护的恒河猴在长达500余天的监测中未检测到病毒。因此,LP-98脂肽也可作为有效的HIV暴露前预防策略(图4)。


图4 LP-98在恒河猴模型的暴露前预防研究
薛婧和何玉先为论文共同通讯作者。薛婧与中国医学科学院病原生物学研究所种辉辉、朱园美为共同第一作者。该项目工作受到国家传染病重大专项、中国医学科学院创新工程和国家自然科学基金的项目资助。
作者使用的艾滋病潜伏感染恒河猴模型已收录于国家人类疾病动物模型资源库,资源标识符为CSTR:16397.09.0G16000448,该模型详细模型信息可查询国家人类疾病动物模型资源库官网https://www.namr.org.cn/Ldesc/1_15,欢迎广大科研学者合作研究。


 京公网安备 11010502043083号
京公网安备 11010502043083号