持续的新冠疫情对人们的经济、生活和健康等带来了极大的危害。患有基础性疾病的患者在感染新冠肺炎后致病性更强和致死率更高。流行病学调查研究显示新冠肺炎患者粗病死率合并心血管疾病(10.5%)和糖尿病(7.3%)排在头两位,远高于未报告合并症的患者(0.9%)。但发生机制有待进一步研究。
中国医学科学院医学实验动物研究所基因工程技术课题组、病理课题组和感染性疾病课题组的研究人员,在中国实验动物学会期刊Animal Model Exp Med发表封面文章,介绍新冠病毒感染共病小鼠模型的建立及比较医学分析工作。
研究人员通过构建携带人源ACE2的腺病毒,结合已有的心肌病小鼠模型和糖尿病小鼠模型,快速建立新冠病毒感染的共病小鼠模型,为已有基础性疾病对新冠病毒感染的影响和机制提供了研究基础。
在研究中使用阿霉素诱导的心肌病小鼠模型、CTnTR141w心肌病转基因小鼠模型和ob/ob糖尿病小鼠模型,利用携带人源ACE2的腺病毒感染小鼠肺部5天后,感染SARS-CoV-2,观察小鼠的体重变化、病毒载量,肺组织病理等。
研究发现,相对于对照小鼠,具有基础性疾病的小鼠在感染SARS-CoV-2后,表现出更严重的肺炎和肺组织病理学改变(图1)。
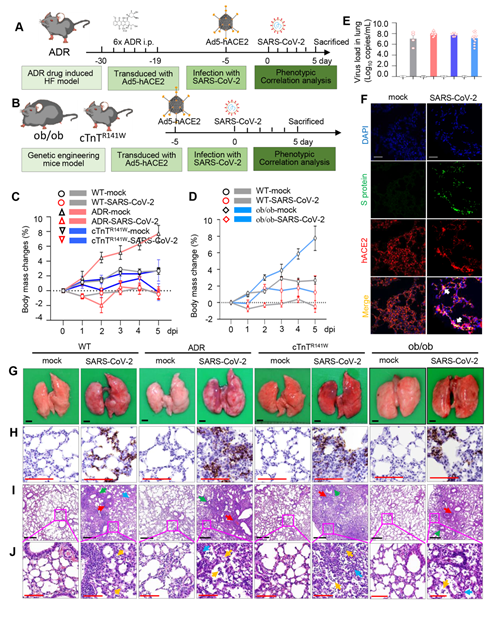
图1. 合并基础性疾病SARS-CoV-2感染后肺部病理表型加重
在心肌病共病小鼠模型中,心肌损伤相关标志物表达显著上调,心肌组织表现出更严重的组织学损伤表型,包括心肌纤维化程度、心肌纤维以及神经纤维断裂等。其中40%的新冠病毒感染心肌病共病小鼠心肌组织中可检测到新冠病毒。分析SARS-CoV-2感染引起的病理改变的信号机制,发现ROS累积以及线粒体介导的凋亡信号的激活可能加剧了心肌损伤(图2,图3)。
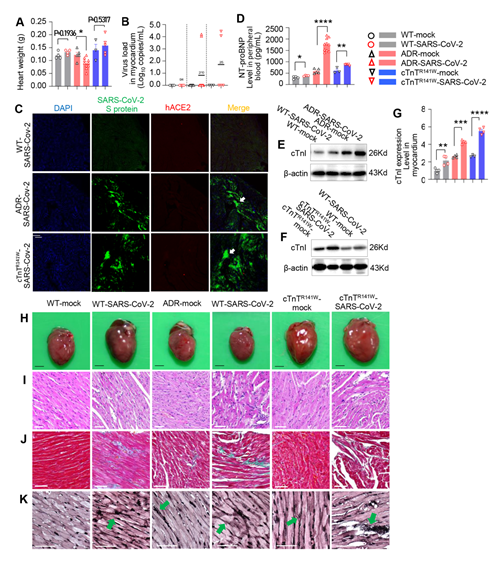
图2. 心肌病感染新冠共病小鼠模型的心脏病理组织学分析
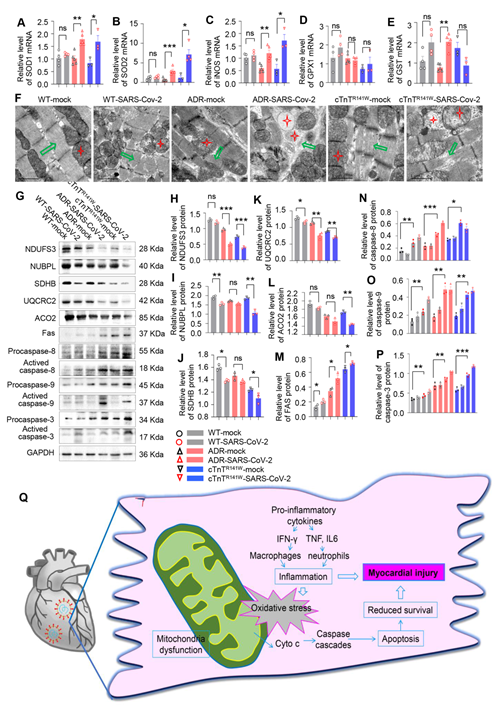
图3 SARS-CoV-2感染心肌病共病小鼠模型心肌损伤机制分析
在糖尿病小鼠模型中,结果显示感染SARS-CoV-2后,小鼠空腹血糖升高,胰岛素应答受损;并且共病小鼠表现出骨质疏松表型,机制分析提示可能是PI3K/AKT/mTOR信号途径受损所致(图4)。
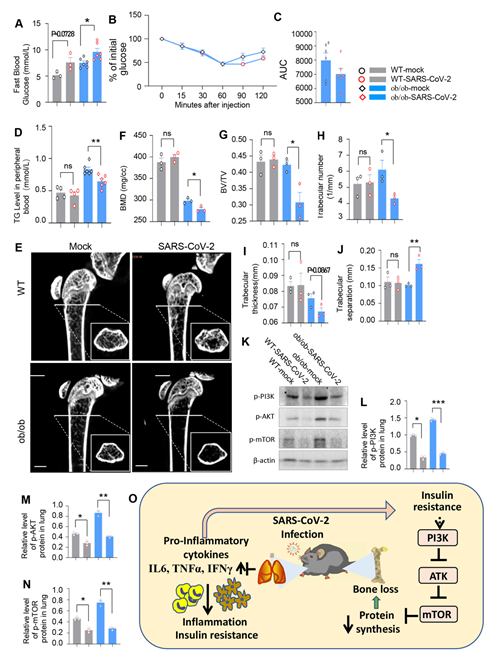
图4 SARS-CoV-2感染糖尿病小鼠模型致病加重表型和信号机制分析
综上,通过建立心肌病、糖尿病感染SARS-CoV-2的共病小鼠模型,为基础性疾病感染SARS-CoV-2后的病理进程和机制研究提供了动物模型。这项工作受到了国家自然科学基金、传染病重大专项、医科院创新工程以及北京市自然基金项目的支持。
参考文献
Ma Y, Lu D, Bao L, Qu Y, Liu J, Qi X, Yu L, Zhang X, Qi F, Lv Q, Liu Y, Shi X, Sun C, Li J, Wang J, Han Y, Gao K, Dong W, Liu N, Gao S, Xue J, Wei Q, Pan S, Gao H, Zhang L, Qin C. SARS-CoV-2 infection aggravates chronic comorbidities of cardiovascular diseases and diabetes in mice. Animal Model Exp Med. 2021 Mar 6;4(1):2-15. doi: 10.1002/ame2.12155. PMID: 33738432; PMCID: PMC7954823.


 京公网安备 11010502043083号
京公网安备 11010502043083号