| 标识符 | CSTR:16397.09.0J01001259 |
|---|---|
| 资源中文名称 | 小鼠乳头瘤病毒皮肤感染模型 |
| 资源英文名称 | A mouse model for papillomavirus-mediated skin disease |
| 疾病概述 | 1.病原学 乳头瘤病毒(Papillomaviruses, PV)为无包膜双链DNA病毒,可感染粘膜和/或皮肤上皮细胞,具有高度宿主特异性。人乳头瘤病毒(human papillomaviruses, HPV)可导致人类宫颈癌、皮肤癌、口腔癌、肛门癌等恶性病变,目前尚无针对HPV感染后病变或引起恶性癌症的治疗方法。由于病毒的宿主特异性,HPV感染人,不能感染其它动物,这限制了病毒感染动物模型的建立。 2011年印度科学家发现小鼠乳头瘤病毒(Mouse papillomavirus type 1, MmuPV1)可感染实验室小鼠品系,首次为乳头瘤状病毒感染小鼠实验模型制备提供机会。与HPV一样,MmuPV1也属于乳多空病毒科乳头瘤病毒属,由闭合环状双链DNA分子组成,其长度为7510bp,含有一条编码链,至少编码7个ORFs。 乳头瘤病毒对热敏感,70℃ 30分钟可灭活,但在室温干燥环境下3天,病毒活力仍有50%。乙醇、异丙醇、戊二醛、邻苯二甲醛、苯酚等常用消毒剂均无法杀灭病毒。0.55%次氯酸钠和1.2%过氧乙酸可灭活病毒。 |
| 实验动物背景信息 | SPF级6-8周龄NU/NU nude mouse,雌性购自北京维通利华实验动物技术有限公司。该品系小鼠来源于NIH,专业名称Crl: NU-Foxn1nu,为无毛、白化背景,因携带Foxn1nu突变,胸腺发育不良,不能产生T细胞。 |
| 模型制作方法 |
三溴乙醇小鼠麻醉,按每公斤体重腹腔注射240mg。待小鼠麻醉后,利用刀片在小鼠尾部反复轻轻刮擦20次左右,取10μl病毒液(6×108 VGE)滴加到刮擦过的尾部。每周观察2次,待尾部病变直径接近1cm时,安乐小鼠并收集肿瘤。部分肿瘤组织置于福尔马林固定液用于组织学研究;部分肿瘤组织置于液氮中速冻,并保存于-80℃进行后续感染和分子研究。
使用分离柱法分离组织DNA。取MmuPV1感染尾部的增生部位,利用DNeasy Blood & Tissue Kit (Qiagen)。提取方法如下:将25mg切成尽量小块置于1.5ml EP管中,加入180μl Buffer ATL及20μl Proteinase K,震荡混匀,56℃孵育1-3h至增生组织完全裂解,孵育期间间断震荡;震荡15s,加入200μl Buffer AL,震荡充分混合,加入200μl无水乙醇,再次充分震荡混匀;混合物转移至DNeasy Mini spin column,6,000×g(8,000 rpm)离心1min,弃废液;柱子中加入500μl Buffer AW1,6000×g(8000 rpm)离心1min,弃废液;柱子中加入500μl Buffer AW2,20,000×g(14,000 rpm)离心3min,弃废液;将珠子置于新的1.5ml或2ml离心管,在柱子的膜上加200μl Buffer AE,室温静置1min,≥6000×g(8000 rpm)离心1min。
将小鼠尾部增生组织置于PBS中,利用匀浆器高速匀浆3min。匀浆液10,000 rpm离心3min,将上清液转移到新1.5ml EP管中。配置反应体系,上下游引物分别为对MmuPV1 E2基因,MmuPV1_E2_1(5`- GCC CGA AGA CAA CAC CGC CAC G-3`)和MmuPV1_E2_2(5'-CCT CCG CCT CGT CCC CAA AAA ATG G-3')。反应条件:95℃ 10min;95℃ 15s;60℃ 60s,68℃ 45s,40个循环;68℃ 10min。
安乐小鼠,解剖采集尾部增生部位皮肤,进行苏木精-伊红(HE染色)。方法简述:组织块经10%的多聚甲醛固定、脱水透明后,置于熔化的石蜡中进行包埋,进而制作石蜡切片;切片脱蜡后进行HE染色;进一步的脱水透明,封片,显微镜下观察。
安乐小鼠,解剖采集尾部增生部位皮肤置于10%多聚甲醛固定、脱水透明后,置于熔化的石蜡中进行包埋,进而制作石蜡切片,切片进行后续RNAscope原位杂交,具体实验步骤如下: (1)载玻片脱蜡:60℃烤片1h,二甲苯脱蜡2次,每次5min,100%酒精2次,每次1min,切片朝上放到吸水纸上,室温静置干燥5min; (2)双氧水靶标修复:切片滴加约5-8滴RNAscope®双氧水,室温孵育10min,蒸馏水清洗切片3-5次后,将载玻片浸没到煮沸的1×RNAscope®靶标修复液中放置15min,蒸馏水清洗3-5次,100%乙醇中清洗1次,室温静置干燥; (3)画疏水圈:使用ImmedgeTM疏水笔在样本周围化疏水圈2-4次; (4)将载玻片置于HybEZTM载玻片架中,滴加5滴RNAscope®蛋白酶plus,放入HybEZTM湿盒,放回40℃杂交炉 30min。蒸馏水洗3次; (5)探针杂交:载玻片滴加4滴E1^E4探针,再放入湿盒,杂交炉40℃孵育2h,将载玻片浸没于1×清洗缓冲液中,室温,每次2min; (6)杂交Amp1:载玻片上滴加4滴Amp1,放回湿盒,杂交炉杂交炉40℃孵育30min,将载玻片浸没于1×清洗缓冲液中,室温,每次2min; (7)杂交Amp2:载玻片上滴加4滴Amp2,放回湿盒,杂交炉杂交炉40℃孵育15min,将载玻片浸没于1×清洗缓冲液中,室温,每次2min; (8)杂交Amp3:载玻片上滴加4滴Amp3,放回湿盒,杂交炉杂交炉40℃孵育30min,将载玻片浸没于1×清洗缓冲液中,室温,每次2min; (9)杂交Amp4:载玻片上滴加4滴Amp4,放回湿盒,杂交炉杂交炉40℃孵育15min,将载玻片浸没于1×清洗缓冲液中,室温,每次2min; (10)杂交Amp5:载玻片上滴加4滴Amp5,放回湿盒,杂交炉杂交炉40℃孵育30min,将载玻片浸没于1×清洗缓冲液中,室温,每次2min; (11)杂交Amp6:载玻片上滴加4滴Amp6,放回湿盒,杂交炉杂交炉40℃孵育15min,将载玻片浸没于1×清洗缓冲液中,室温,每次2min; (12)信号检测:弃掉液体后,载玻片上滴加120μl DAB工作液,室温静置10min,去除DAB工作液,蒸馏水洗3-5次; (13)载玻片复染:载玻片放入苏木精染色液中,室温静置2min,蒸馏水洗3-5次,利用0.02%氨水洗一次,蒸馏水再洗3-5次; (14)载玻片脱水:载玻片放入70%乙醇,室温静置2min,100%酒精,室温静置2min,100%酒精,室温静置2min,二甲苯溶液,室温静置5min; (15)封片:载玻片风干后,滴加1滴Cytoseal封片剂,盖上盖玻片,风干载玻片5min。
TRIzol法提取尾部增生皮肤(实验组)及尾部正常皮肤(空白对照组)样本RNA,通过琼脂糖凝胶电泳分析RNA完整性及是否有DNA污染、Nanodrop进行RNA浓度和纯度检测。送到北京诺禾致源科技股份有限公司测序平台进行RNA测序。通过文库构建并测序获得原始测序序列后进行信息分析流程,主要由两个阶段:a)评估测序数据质量;b)信息挖掘及分析。将实验组与对照组RNA-seq序列进行对比,鉴定分析差异基因表达和聚类分析(包括差异基因数目统计、GO富集分析、KEGG通路富集分析),采用edgeR软件进行表达差异显著性分析。 |
| 模型表型数据 |
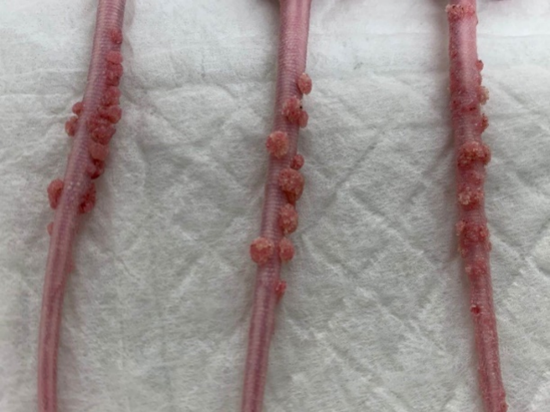
肉眼观察可见,感染后4周左右部分小鼠尾部皮肤即出现轻微增生,16周后可观察到明显病变(图1)。
图1 MmuPV1感染NU/NU小鼠尾部增生模型
MmuPV1感染尾部提取总DNA,利用对MmuPV1 E2基因特异性引物扩增鉴定MmuPV1表达。结果表明, 9只感染MmuPV1的小鼠尾部均建立MmuPV1持续感染,并可检测到MmuPV1 DNA(图2)。
图2感染小鼠尾部MmuPV1 E2基因PCR鉴定 1-9:MmuPV1感染小鼠尾部DNA; 10:MmuPV1质粒(阳性对照) ; 11:未感染小鼠尾部DNA(阴性对照);12:水(空白对照); M:Trans 2k Plus DNA Marker
用MmuPV1感染NU/NU小鼠尾部,16周后出现明显增生,收集增生部位用10%福尔马林固定,苏木精伊红染色(HE染色)后进行病理分析。组织学观察可见感染的小鼠尾部表面鳞状上皮增生(图3)。因为MmuPV1 E1^E4转录本存在于大多数乳头瘤病毒早期和晚期转录过程,即利用RNAscope原位杂交检测MmuPV1 E1^E4转录本表达,发现尾部增生部位转录本的表达为明显阳性(棕色)(图4A),而阴性探针组未检测到信号(图4B)。
图3 MmuPV1感染小鼠尾部病变HE染色分析(100X)
图4 RNAscope原位杂交检测感染小鼠尾部病变MmuPV1 E1^E4转录本 A: RNAscope原位杂交E1^E4转录本检测;B:RNAscope原位杂交阴性探针对照
NU/NU小鼠尾部感染MmuPV1 16周后,尾部增生皮肤(实验组Tail)及尾部正常皮肤(空白对照组Tail C)差异基因表达分析。结果表明,与对照组比,实验组有2653个基因表达上调(红色点),2306个基因表达下调(绿色点),蓝色点表示未发生显著变化的基因,其中横坐标表示基因表达的倍数变化(log2FoldChange),其中绝对值越大表明,与对照组相比,实验组表达变化倍数越大;纵坐标表示表达差异的显著水平,Y轴1.3附近虚线对于P value=0.05(图5A)。根据GO富集分析(图5B),差异基因主要与皮肤上发育、核糖体合成、嘌呤核苷酸代谢等生物进程有关;将差异基因进行KEGG功能富集到癌症信号通路、核糖体合成相关信号通路等,说明其可能直接或间接参与MmuPV1感染尾部皮肤后病变的发生(图5C)。
图5MmuPV1感染小鼠尾部转录水平差异表达 A:差异表达基因火山图;B:GO富集分析结果;C:KEGG通路富集分析结果 |
| 动物模型的评价与验证 | MmuPV1感染小鼠模型的评价方法包括皮肤观察、病理检测、RNAscope原位杂交、PCR方法等;采用的仪器设备定期检验,条件稳定,满足模型评价的要求。 |
| 保存方式 | 活体 |
| 合作方式 | 仅限合作研究 |
| 相关文章 | |
| 备注 |






 京公网安备 11010502043083号
京公网安备 11010502043083号