| 标识符 | CSTR:16397.09.0B01000741 |
|---|---|
| 资源中文名称 | APCMin/+小鼠自发性结直肠癌癌前病变模型 |
| 资源英文名称 | Mouse model of spontaneous colorectal cancer |
| 疾病概述 | 家族性腺瘤性息肉病(Familial Adenomatous Polyposis,FAP)是结直肠癌发生的癌前病变,患者结直肠部位多发成百上千个腺瘤性息肉,抑癌基因APC的突变是结直肠肿瘤的起始因素。Dove实验室于1990年建立了C57BL/6J-APCmin/+小鼠品系,是在小鼠同源APC基因第850位点发生无义突变,造成其肠道多发腺瘤,被认为是一种良好的FAP小鼠模型。 |
| 实验动物背景信息 | 1、APCmin基因信息 APC(adenomatosis polyposis coli)基因编码的蛋白是一种肿瘤抑制蛋白,充当Wnt信号传导途径的拮抗剂。APC-β-catenin-TCF主导的Wnt通路失调是家族腺瘤息肉病发生的主要途径。APC蛋白表达的缺失或降低可能导致β-catenin免于降解,使游离的β-catenin在胞浆内集聚并进入核内,激活相关靶癌基因,导致细胞癌变的发生。APC蛋白还涉及其他生物调节过程,包括细胞迁移和粘附,转录激活和细胞凋亡。APC-Min(Min: multiple intestinal neoplasia)突变小鼠特指APC基因第850位氨基酸出现突变的C57BL/6J小鼠。APC基因第850位氨基酸从Leu突变成终止密码子,导致翻译提前终止。APC-Min小鼠品系采用基因编辑技术制作,该品系纯合子不能存活。高脂饮食条件下,雄性和雌性杂合小鼠有明显的肠道腺瘤且数量较多,多见于回肠和空肠。因此,APC-Min小鼠模型是理想的肠道肿瘤模型。 APCMin/+小鼠发病机制是突变的基因产物,截短APC蛋白导致肠道上皮细胞胞质β-catenin蛋白的积累而后使其入核与TCF4/LEF转录因子结合启动下游基因CyclinD 1等原癌基因的活化,但是其腺瘤发生、发展规律和其他生物学特性尚未探索清楚。 3、研究背景 结直肠癌是世界上第三大恶性肿瘤[1]。从肿瘤学角度研究,结结肠癌的诱发与DNA的错配修复密切相关,并涉及到多个癌症相关基因的复杂变化过程[2-4]。1991年研究人员发现,结肠腺瘤性息肉基因(adenomatous polyposis coil,APC)是诱发家族性腺瘤息肉病(famolial adenomatous polyposis,FAP)的主要原因,且APC基因突变是诱发结直肠癌发生的早期事件[5]。FAP的主要特征是:结直肠中发育异常的病灶逐渐增长,并发展成为数百或数千个腺瘤性息肉或腺癌。APC主要在细胞核、浆中发挥重要的作用,并在机体多个组织器官和肿瘤细胞系中表达,如肝脏、肠和肠癌细胞系等[6-7]。结直肠肿瘤的发生发展是多基因,多步骤参与的过程,与生活方式、饮食结构、遗传因素和多基因突变都密切相关。由于在人体研究存在诸多限制,因此需要一种客观性、重复性、公认性均较好的动物模型进行深入研究。 [1] FERLAY J, SHIN H R, BRAY F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008 [J]. International journal of cancer, 2010, 127(12): 2893-2917. [2] DE LA CHAPELLE A. Genetic predisposition to colorectal cancer [J]. Nature reviews cancer, 2004, 4(10): 769-780. [3] MECKLIN J P. Frequency of hereditary colorectal carcinoma [J]. Gastroenterology, 1987, 93(5): 1021-1025. [4] PONZ DE LEON M, SASSATELLI R, SACCHETTI C, et al. Familial aggregation of tumors in the three-year experience of a population-based colorectal cancer registry [J]. Cancer research, 1989, 49(15): 4344-4348. [5] KINZLER K W, NILBERT M C, SU L K, et al. Identification of FAP locus genes from chromosome 5q21 [J]. Science, 1991, 253(5020): 661-665. [6] Su LK, Kinzler KW, Vogelstein B, Preisinger AC, Moser AR, Luongo C, Gould KA, Dove WF. Multiple intestinal neoplasia caused by a mutation in the murine homolog of the APC gene. Science, 1992, 256(5057): 668−670. [7] Silverman KA, Koratkar R, Siracusa LD, Buchberg AM. Identification of the modifier of Min 2 (Mom2) locus, a new mutation that influences Apc-induced intestinal neo-plasia. Genome Res, 2002, 12(1): 88−97. |
| 模型制作方法 | APCMin/+小鼠,C57BL/6J小鼠,体重秤,清洁级动物房,手术剪,耳标,IVC笼盒,Co60照射的高脂饲料,PBND,蛋白酶K, promega GO TAQ Green Master Mix, takara 100bp DNA ladder, TBE缓冲液,亚甲蓝,小鼠抗人β-catenin单克隆抗体(BD Trans-ductionLaboratorie,Cat,610154),小鼠抗人cyclinD 1(SantaCruz,Cat,sc-8396);二抗为过氧化辣根酶标记山羊抗小鼠IgG, DAB显色液,苏木精染液,显微镜,凝胶成像仪,甘油三酯试剂盒及总胆固醇试剂盒等。 实验操作规程: APCMin/+雄性成年小鼠和C57雌性成年小鼠以1∶2的比例杂交,三个月后,其F1代中既有APCMin/+小鼠(腺瘤表型),又有C 57小鼠,进行全同胞兄妹交配,扩大种群。使用PCR方法对新生小鼠进行剪尾提取基因签定。小鼠在正常饲养时或者高脂饲料饲养时均会出现肠道肿瘤,但是肿瘤数量,体积随着饲养年龄增长而具有明显差异。 |
| 模型表型数据 | 1、 细胞/基因/蛋白表达/免疫组化 鉴定信息 基因鉴定结果(wildtype:600bp;trangenic band:340bp)
图1 APCMin/+基因鉴定图
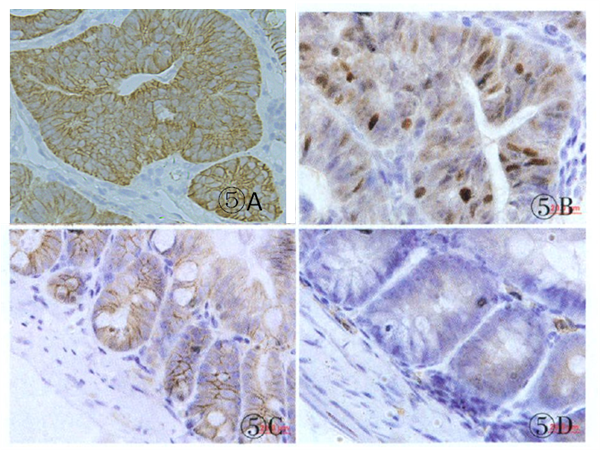
组织化学染色结果
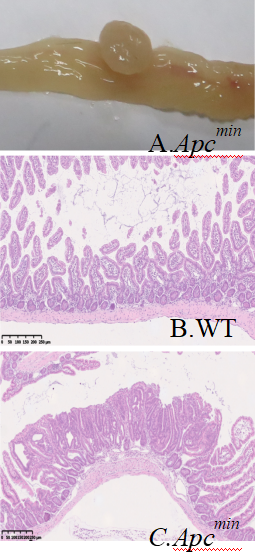
图2 免疫组织化学染色结果 A、B分别为小肠腺瘤部位β-catenin和cyclinD 1染色;C、D分别为正常腺体β-catenin和cyclinD 1染色 2、表型分析概述 解剖学: APCMin/+小鼠腺瘤多发生在小肠部位,约70个,而结直肠上只有1~5个腺瘤。小肠和结直肠部位的腺瘤病理形态不尽一致:小肠腺瘤多数为扁平或溃疡状,质地较疏松;结直肠腺瘤为椭球状或带蒂息肉,质地较致密(图3A、B)。显微镜下观察腺瘤的组织病理形态,小肠腺瘤多数为管状绒毛状腺瘤,而大肠腺瘤多数为管状腺瘤(图3C、D);较大的腺瘤其腺管呈现不规则分支、“背靠背”和共壁现象,瘤细胞明显复层化,部分核上浮至腔缘,核极向消失,具有明显异型性。
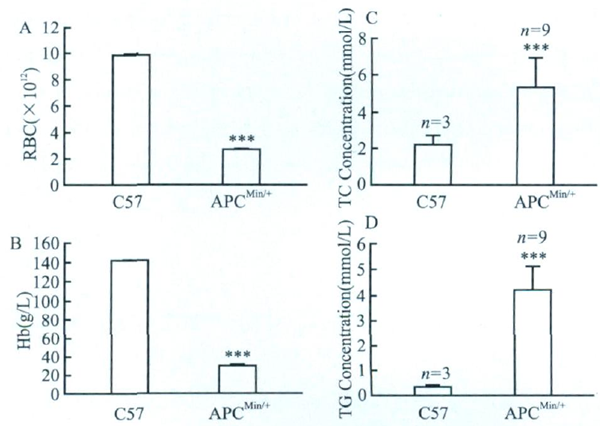
图3 APCMin/+小肠部位的腺瘤 A、B、C分别为小肠大体图片; 正常小肠和小肠腺瘤HE图片 生理生化: 24周APCMin/+小鼠有明显贫血症状:脚掌及耳廓苍白,脾脏的重量是同周龄的野生型C57小鼠的8~10倍,外周血红细胞数相比C57小鼠减少4倍血红蛋白含量减少约5倍(图4B)。 18周以后的APCMin/+小鼠血清为乳白色,24周APCMin/+小鼠血清中总胆固醇(TC)上调约3倍(图4C),甘油三酯(TG)上调10倍(图4D)。
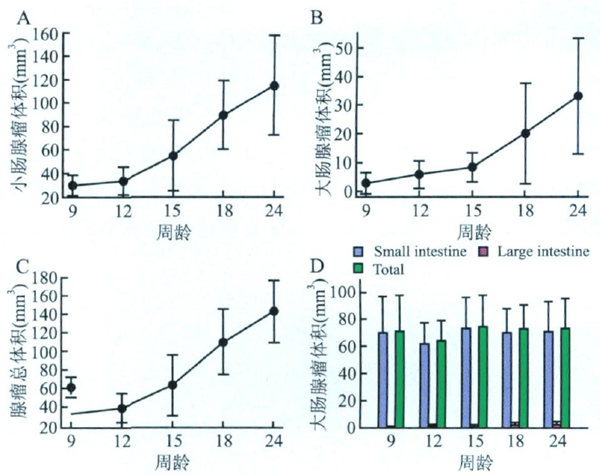
图4 24周APCMin/+小鼠红细胞数及血红蛋白、总胆固醇及甘油三酯含量 A.外周血红细胞数;B.血红蛋白;C.血清总胆固醇;D.血清甘油三酯;**P<0.01;***P<0.001 生物学特性: 取4只6周龄的小鼠取其肠道体式解剖显微镜下观察,有2只(2/4)小肠中有较小的腺瘤,而结直肠未见腺瘤;APCMin/+小鼠在24周龄时多数死亡,这也与其它文献报道相一致。鉴于这些观察结果,分别选定9、12、15、18、24周龄的小鼠各10只,统计测定小肠和大肠的腺瘤数目和体积(图5),小肠腺瘤数目分别为69、62、71、69、72,说明9周时小肠腺瘤已形成,随后小肠腺瘤数目不再增加;大肠腺瘤数目分别为0.6、1.2、1.8、3.2、3.6,说明随着周龄的增加,大肠上的腺瘤数目有所增加(图3D)。各周龄时,小肠上的腺瘤总体积分别为30、34.4、55.3、90.3、115.6mm 3(图5A),大肠上的腺瘤总体积分别为2.9、5.9、8.4、20.1、33.2mm 3(图5B),整个肠道腺瘤总体积分别为32.8、40.2、63.8、110.4、148.8mm 3(图5C),由此可见,腺瘤在15周以后处于一种快速生长状态。
图5 APCMin/+小鼠肠道腺瘤发展规律 A 小肠腺瘤体积;B. 大肠腺瘤体积;C.肠道总腺瘤体积;D.肠道腺瘤数目 3、病理表型: APCMin/+小鼠整个生命周期内的肠道腺瘤发生、发展规律:9周时腺瘤形成,随后小肠腺瘤数目不变,体积不断增大,15周以后腺瘤快速生长,24周时可能由于腺瘤体积过大及其对营养的消耗而导致贫血从而使多数小鼠致死。APCMin/+小鼠血清中甘油三酯(TG)上调约10倍,总胆固醇(TC)上调约3倍,提示高脂血症可能与结直肠癌正相关。血清中高表达的甘油三酯和总胆固醇可能通过调节WNT信号通路下游基因PPARδ的表达而促进腺瘤的发生。APCMin/+小鼠较大腺瘤有显著的组织结构及细胞异型性,但是黏膜下层未见腺体侵袭浸润,说明增生性的腺体有一定的癌细胞特性,但尚未发展成癌。 |
| 动物模型的评价与验证 | 该模型使用HE方法对APC min小鼠的小肠大肠部位进行病理评估,确认小鼠在小肠和大肠部位可以形成腺瘤,比较不同周龄小鼠的腺瘤数目和大小,发现腺瘤的发生发展规律。通过免疫组织化学染色方法确定β-catenin的表达量变化,进而助于阐明其发病机制。通过检测24周龄小鼠的红细胞数及血红蛋白、总胆固醇及甘油三酯含量,发现随着腺瘤数目和体积的增大对小鼠的影响。 |
| 保存方式 | 冷冻 |
| 合作方式 | 仅限合作研究 |
| 相关文章 | |
| 备注 |



 京公网安备 11010502043083号
京公网安备 11010502043083号