| 标识符 | CSTR:16397.09.0C01000024 |
|---|---|
| 资源中文名称 | hCoV-EMC(MERS-CoV )滴鼻途径感染hDPP4-BALB/c 小鼠模型 |
| 资源英文名称 | hCoV-EMC (MERS-CoV) virus intranasally infected hDPP4-BALB/c mouse model |
| 疾病概述 | 2012 年6 月埃及病毒学家Zaki 从沙特一位患有急性肺炎并伴发急性肾衰竭的男性患者中分离到了一株冠状病毒。随后他把病毒样本送到了荷兰鹿特丹伊拉斯姆斯大学医学中心(Erasmus Medical Center),Ron Fouchier 教授最终证实的确是一种以前没有见过的冠状病毒,命名为 HCoV-EMC,是一种不同于SARS 冠状病毒(SARS-CoV)的新型冠状病。 随后英国的科学家也确认了一名来本国就医的卡塔尔患者也感染了这种新型冠状病毒,症状亦是严重呼吸综合征,将该病毒命名为人冠状病毒-England 1( human coronavirus England 1)。后续经证实两病例感染的病毒为同一病毒,序列比对有99.5%的相似性。 2012 年9 月23 日,世界卫生组织发布公告,确认有2 名患者感染了新型冠状病毒,两人临床表现为急性呼吸道感染,并伴有急性肾衰竭。此后几个月该病毒在中东地区接连出现,并出现了小群体传播事件。另外一些欧洲、美洲、非洲国家也出现来自中东的输入病例,分离的毒株也越来越多,并各自命名,比如 human betacoronavirus 2CJordan-N3、human betacoronavirus 2c England-Qatar 等。为统一新型冠状病毒名称,方便新型冠状病毒感染病例的通报,2013 年5月国际病毒分类委员会冠状病毒研究小组将此新型冠状病毒命名为中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus, MERS-CoV)。 |
| 实验动物背景信息 | MERS感染的恒河猴、狨猴动物模型成本较高、操作复杂,制约其在实验中大规模使用。建立一个经济实用的小动物模型作为灵长类模型的有益补充非常必要。BALB/c小鼠由于其良好的性能(遗传背景均一、个体差异小等优点)已被广泛应用于科学研究。然而BALB/c小鼠缺乏MERS-CoV的受体DPP4( 亦称CD26),自然情况下是不能被感染的。 利用不同剂量DPP4转导SPF级雌性BALB /c小鼠后建立MERS-CoV感染的动物模型。 |
| 模型制作方法 | MERS-CoV (hCoV-EMC,GenBank: MH454272.1)由荷兰伊拉斯姆斯大学医学中心Ron Fouchier 教授馈赠。Ad5-DPP4 由美国爱荷华大学微生物与儿科学教研室赵金存教授馈赠。 DPP4 转导组小鼠在MERS-CoV 攻毒前,滴鼻转导Ad5-DPP4。高剂量DPP4 转导组转导剂量为2.5×108 PFU/50μl/只,低剂量DPP4 转导组转导剂量为0.5×108 PFU/50μl/只,PBS 对照组鼻腔滴入50μl PBS。DPP4 转导处理后5 天,进行MERS-CoV 滴鼻攻毒,攻毒剂量为5×105TCID50/50μl/只。观测临床症状和死亡情况。动物安乐死后,取肺组织制备病理标本,进行HE染色和免疫组化染色。剩余3只进行肺灌洗,用于病毒滴度和病毒载量测定。感染后14天,取血,分离血清用于IgG抗体和中和抗体检测。 |
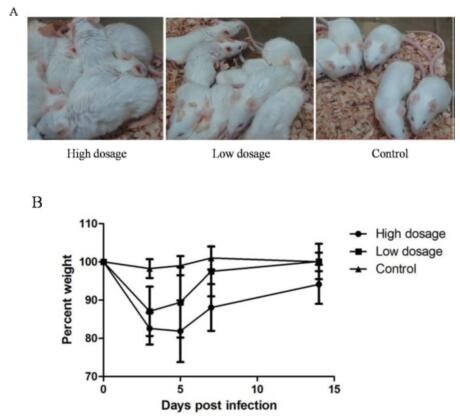
| 模型表型数据 | 1、不同剂量DPP4转导后MERS-CoV感染小鼠体征 MERS-CoV攻毒后,各组小鼠均无死亡。但DPP4转导组小鼠均出现了明显的感染症状,主要表现为精神不振、弓背、蜷缩、竖毛、活动少、扎堆等(图1A)。高剂量DPP4转导组小鼠较低剂量DPP4转导组小鼠症状更为明显,持续时间也较长。PBS对照组小鼠无任何临床症状。攻毒后DPP4转导组小鼠均出现明显的体重下降,高剂量DPP4转导组小鼠体重下降更为明显。高剂量DPP4转导组小鼠攻毒5d后体重开始恢复,而低剂量DPP4转导组小鼠攻毒3d后体重开始恢复。而对照组小鼠体重变化不明显(图1B)。
图1 小鼠MERS-CoV攻毒后临床症状 (A:表型观察;B:MERS-CoV攻毒后体重变化)
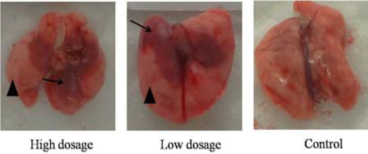
2、不同剂量DPP4转导后MERS-CoV感染小鼠的病理学检查 MERS-CoV感染后3d,大体解剖可见两种剂量DPP4转导组小鼠肺部均有不同程度充血呈暗红色,而对照组小鼠肺部无明显变化(图2)。且高剂量DPP4转导组小鼠肺部病变面积明显大于低剂量DPP4转导组小鼠。显微病理检查可见DPP4转导组小鼠均发生间质性肺炎,表现为肺泡隔中度到重度增宽,肺组织中可见少量到多量炎性细胞浸润和浆液性渗出,炎细胞以巨噬细胞、淋巴细胞和中性粒细胞为主。而对照组小鼠无此变化(图3A)。免疫组化分析表明DPP4转导组小鼠肺组织中可检测到病毒蛋白的表达,阳性细胞主要分布在肺组织的支气管上皮细胞中。对照组小鼠肺中并未检测到病毒特异蛋白的存在(图3B)。
图2 小鼠肺大体解剖图(三角:正常肺组织;箭头:肺部充血)
图3 小鼠肺病理变化(A)与免疫组化染色(B)
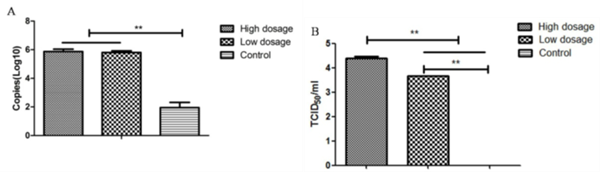
3、不同剂量DPP4转导后MERS-CoV感染小鼠肺组织病毒载量 MERS-CoV攻毒后3天,每组安乐死3只小鼠,取肺组织灌洗液进行病毒滴度和载量测定。DPP4转导组小鼠,肺部均检测到较高的病毒载量,但低剂量和高剂量DPP4转导组小鼠差异不显著(P>0.05)。PBS对照组小鼠肺部检测不到病毒核酸的存在。将肺部灌洗液接种Vero细胞进行病毒分离,发现DPP4转导组小鼠肺部均能分离到MERS-CoV,并且高剂量DPP4转导组小鼠肺部病毒滴度最高。PBS对照组小鼠则分离不到病毒(图4)。
图4、小鼠肺组织病毒核酸载量检测(A)与病毒滴度测定(B)
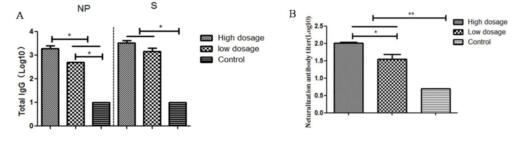
4、不同剂量DPP4转导后MERS-CoV感染小鼠血清IgG抗体和中和抗体 攻毒后14d,采集各组小鼠血液,分离血清进行特异性IgG抗体以及中和抗体检测。ELISA结果显示各DPP4转导组小鼠均可诱导NP和RBD特异性IgG抗体。其中,高剂量DPP4转导组小鼠诱导的NP特异性IgG抗体水平高于低剂量DPP4转导组小鼠(p<0.05, 图5A)。微量中和试验结果(图5B)显示DPP4转导组小鼠均产生了中和抗体,特别是高剂量DPP4转导组小鼠较低剂量DPP4转导组小鼠产生了更高滴度的中和抗体,两者差异显著(p<0.05)。PBS对照组小鼠血清中检测不到特异性IgG抗体以及中和抗体的存在。
图5 MERS-CoV感染小鼠模型的血清抗体应答检测 (A:抗原特异性IgG抗体;B:血清中和抗体) |
| 动物模型的评价与验证 | |
| 保存方式 | |
| 合作方式 | |
| 相关文章 | [1] 姚艳丰,蓝佳明,李枫棣,牛培华,于品,卢帅,鲍琳琳,谭文杰,秦川. 不同剂量DPP4 转导后MERS-CoV感染小鼠模型的临床及生物学特征比较. 病毒学报. 2015,6(31):593-600. DOI:10.13242/j.cnki.bingduxuebao.002817. |
| 备注 |



 京公网安备 11010502043083号
京公网安备 11010502043083号