| 标识符 | CSTR:16397.09.0L01000387 |
|---|---|
| 资源中文名称 | 脑组织特异 Cre 转基因小鼠 |
| 资源英文名称 | B6.Tg(CaMK2-Cre) |
| 疾病概述 | 神经相关工具小鼠 |
| 实验动物背景信息 | C57BL/6 |
| 模型制作方法 | 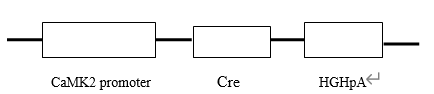 |
| 模型表型数据 | CaMK2(钙/钙调素依赖性蛋白激酶II,CaM激酶II)是一种广泛存在于大脑中的丝氨酸/苏氨酸蛋白激酶,是突触后密度(PSD)的主要组成部分。这种酶是一种寡聚蛋白质,由不同但相关的亚单位α、β、γ和δ组成,每个亚单位由一个单独的基因CAMK2A与其他CAMK2亚基组装成异寡聚物。Chen等人(1994)表明,缺乏Camk2a基因的敲除小鼠表现出行为异常。杂合子小鼠表现出明显的局限性综合征,主要由恐惧反应减少和防御攻击增加组成,没有任何可测量的认知缺陷。与杂合子不同的是,纯合子在所有被试中都表现出异常行为。在细胞水平,细胞外和全细胞膜片钳记录表明中缝背侧5-羟色胺能神经元的5-羟色胺释放减少。因此,Camk2a基因敲除小鼠,特别是杂合子,可能为研究涉及恐惧和攻击的情绪障碍的分子和细胞基础提供一个模型。 Rotenberg等人研究Ca(2+)/钙调素依赖性蛋白激酶激活型(CaMKII-asp286)对转基因小鼠的影响。正常情况下,空间位置编码为单个海马锥体细胞的放电模式。当一只动物在熟悉的环境中移动时,当它进入空间的不同区域时,海马体中不同位置的细胞就会开火。发现CaMKII-asp286转基因小鼠缺乏低频LTP,在海马CA1区没有形成稳定的“位置细胞”。在行为学上,小鼠在空间记忆任务中受损。这些结果表明,长时程增强对位置细胞的微调和稳定非常重要,这些位置细胞的特性可能对空间学习非常重要。苏氨酸-286残基处的自磷酸化赋予α-CaMKII从钙调素依赖性状态转换为钙调素非依赖性状态的能力。Giese等人研究了小鼠Camk2a基因点突变对长时程增强和学习的影响,该点突变阻断了α-CaMK2的thr286处的自磷酸化。作者用Pointlox程序引入了thr286到ala的突变。这种突变导致一种激酶不能转换到钙调素非依赖状态,但不影响钙调素依赖活性。突变小鼠海马CA1区无NMDA受体依赖性长时程增强,Morris水迷宫无空间学习。因此,Giese等人得出结论,thr286处α-CaMKII的自磷酸化似乎是长时程增强和学习所必需的。 |
| 动物模型的评价与验证 | 钙调蛋白依赖蛋白激酶CaMK2(Calcium/calmodulin-dependent protein kinase II (CaM kinase II)基因主要在大脑中表达,利用CaMK2启动子建立的Cre转基因小鼠是进行大脑条件基因剔除(conditional knock-out)的工具小鼠。 |
| 保存方式 | 冷冻 |
| 合作方式 | 仅限合作研究 |
| 相关文章 |
1. Bayer K-U, De Koninck P, Leonard AS, et al. Interaction with the NMDA receptor locks CaMKII in an active conformation. Nature 411: 801-805, 2001. 2. Chen C, Rainnie DG, Greene RW, et al. Abnormal fear response and aggressive behavior in mutant mice deficient for alpha-calcium-calmodulin kinase II. Science 266: 291-294, 1994. 3. Cho YH, Giese KP, Tanila H,et al. Abnormal hippocampal spatial representations in alpha-CaMKII(T286A) and CREB(alpha-delta-) mice. Science 279: 867-869, 1998. 4. Elgersma Y, Fedorov NB, Ikonen S, et al.Inhibitory autophosphorylation of CaMKII controls PSD association, plasticity, and learning. Neuron 36: 493-505, 2002. 5. Frankland PW, Bontempi B, Talton LE, et al.The involvement of the anterior cingulate cortex in remote contextual fear memory. Science 304: 881-883, 2004. 6. Frankland PW, O'Brien C, Ohno M, et al. Alpha-CaMKII-dependent plasticity in the cortex is required for permanent memory. Nature 411: 309-313, 2001. 7. Karcher RL, Roland JT, Zappacosta F,et al. Cell cycle regulation of myosin-V by calcium/calmodulin-dependent protein kinase II. Science 293: 1317-1320, 2001. 8. Li G, Laabich A, Liu LO,et al. Molecular cloning and sequence analyses of calcium/calmodulin-dependent protein kinase II from fetal and adult human brain: sequence analyses of human brain calcium/calmodulin-dependent protein kinase II. Molec. Biol. Reports 28: 35-41, 2000. 9. Lu CS, Hodge JJL, Mehren J, et al.Regulation of the Ca(2+)/CaM-responsive pool of CaMKII by scaffold-dependent autophosphorylation. Neuron 40: 1185-1197, 2003. 10. Matsumoto Y, Maller JL, Calcium, calmodulin and CaMKII requirement for initiation of centrosome duplication in Xenopus egg extracts. Science 295: 499-502, 2002. 11. Thiagarajan TC, Piedras-Renteria ES, Tsien RW.Alpha- and beta-CaMKII: inverse regulation by neuronal activity and opposing effects on synaptic strength. Neuron 36: 1103-1114, 2002. |
| 备注 |


 京公网安备 11010502043083号
京公网安备 11010502043083号