| 标识符 | CSTR:16397.09.0G01001128 |
|---|---|
| 资源中文名称 | 重症EV71动物模型 |
| 资源英文名称 | |
| 疾病概述 | 手足口病(hand, foot, and mouth disease, HFMD)是由肠道病毒引起的,以发热和手、足、口腔、臀部等部位出现皮疹、疱疹或疱疹性咽峡炎为主要特征的一种常见于小儿的急性传染病。手足口病多发生于入学前儿童,尤其是3岁以内的婴幼儿,少数患者会发展为重症,并发无菌性脑膜炎、脑干脑炎、神经源性肺水肿、急性弛缓性麻痹和心肌炎等,死亡率和致残率较高。肠道病毒71型(enterovirus 71, EV71)是导致手足口病暴发的主要病原体,是一种高度嗜神经病毒,易导致神经系统感染,发展成重症,对重症死亡患者尸检表明脑干是其最易感染的部位,因此,重症手足口病患者表现出严重的神经系统并发症,以及肺出血、循环障碍、心脏损害等。 |
| 实验动物背景信息 | |
| 模型制作方法 | 根据前期预实验结果确定攻毒量,建立重症EV71小鼠模型,9日龄BALB/c乳鼠轻度麻醉后,经腹腔注射104.5 TCID50临床分离株NX10-147 (GenBank登录号KJ004556),攻毒剂量为250 μl/只;空白对照组乳鼠(n=12)腹腔注射等量RD细胞上清,其中3只取其血清作为对照组血清。分别在3、6、12 hpi 和1、2、3、5、7、9 dpi采集每组各3只乳鼠血清以备检测血清中的细胞因子。在3 dpi和5 dpi每组各剖杀3只乳鼠,立即取其脑干、脊髓、肺脏、后肢骨骼肌和空肠固定在4 %多聚甲醛中,以备组织病理学检测;同时,每组另剖杀3只乳鼠取以上组织冻存,以备病毒RNA提取和组织内病毒定载量测定。 |
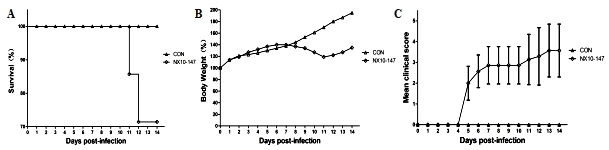
| 模型表型数据 | 采用病毒滴度为104.5 TCID50/ml的EV71(NX10-147)经腹腔注射感染9日龄BALB/c乳鼠,建立重症小鼠模型,6 dpi重症模型小鼠发生后肢瘫痪最终导致死亡;绘制生存率(图1A),体重增长曲线(图1B),临床评分(图1C)。重症小鼠模型在5 dpi时,2/7(28.57%)小鼠发生后肢瘫痪(图2),在7 dpi时,4/7(57.14%)小鼠表现瘫痪,其体重也下降,11~12 dpi重症小鼠出现死亡,生存率为71.43%(5/7),其中存活的小鼠中60%(3/5)出现瘫痪后遗症。
图1. EV71毒株(NX10-147)104.5 TCID50经腹腔注射感染乳鼠建立重症小鼠模型的生存率、体重、临床评分 A. 生存率; B. 体重; C. 临床评分
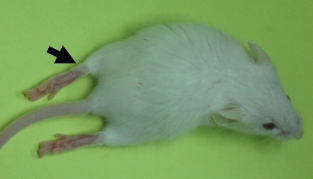
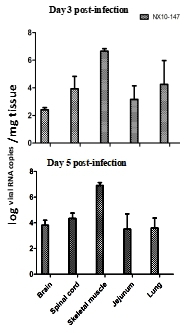
图2. 重症EV71小鼠模型主要症状 重症小鼠模型各组织病毒载量检测 为了进一步探讨重症EV71小鼠模型体内病毒载量情况,采用RT-PCR对3 dpi和5 dpi重症小鼠脑、脊髓、骨骼肌、空肠和肺组织进行病毒核酸检测(图3),发现以上各组织在3 dpi和5 dpi 均检测到EV71病毒,其中,检测到重症模型3 dpi骨骼肌中的高病毒载量(107.0 copies/mg),其中,3 dpi 在重症模型脑组织中均检测到低病毒载量(102.0 copies/mg),5 dpi脑组织中病毒载量增加到104.0 copies/mg,说明5 dpi EV71病毒造成中枢神经系统感染加重。3 dpi在重症模型脊髓、空肠和肺组织中的病毒载量104.0 copies/mg,5 dpi 病毒载量无明显变化,重症小鼠模型中均检测到骨骼肌和脊髓中较高的病毒载量,说明这些组织是病毒复制并传播到脑组织的重要部位。
图3. EV71毒株(NX10-147)104.5 TCID50经腹腔注射感染乳鼠建立重症小鼠模型的组织内病毒载量
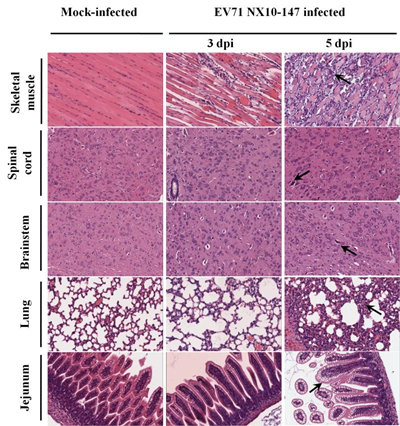
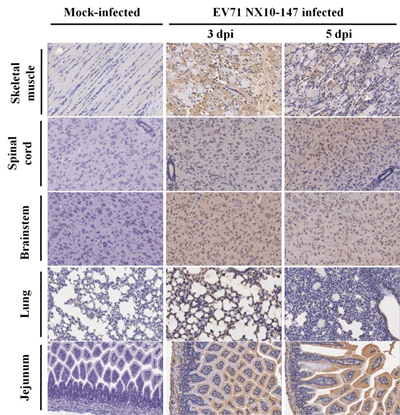
重症小鼠模型组织病理学变化 运用组织病理学和免疫组织化学技术,对重症小鼠模型的各组织器官进行病理学观察。空白对照组小鼠未见明显病理变化,并且EV71抗原呈阴性反应。 对重症小鼠模型(NX10-147)进行组织病理学观察(图4),发现3 dpi和5 dpi 小鼠后肢骨骼肌发生严重的坏死性肌炎,肌纤维断裂,大量炎性细胞浸润,主要有淋巴细胞、嗜中性粒细胞、巨噬细胞;3 dpi 小鼠脊髓和脑干发生细胞源性水肿,神经元发生变性,偶见坏死,5 dpi小鼠脊髓前角运动神经元变性坏死,出现红色神经元,并可见卫星现象和嗜神经现象,脑干组织中的神经元发生不同程度的变性坏死,并且可见脑干和脊髓神经元中的尼氏小体消失;5 dpi肺脏发生大面积间质性肺炎,间质增宽,炎性细胞浸润,肺泡间隔毛细血管淤血,3 dpi和5 dpi肺脏发生局灶性肺气肿;3 dpi和5 dpi空肠黏膜上皮细胞发生大面积空泡变性。免疫组织化学检测发现在上述严重病变的组织中可观察到EV71特异性抗原分布(图5),在3 dpi和5 dpi时,脊髓、脑干、空肠和骨骼肌检测到较强的阳性EV71抗原信号,提示在这些组织中病毒复制活跃,然而在5 dpi时,肺脏检测到中等强度阳性EV71抗原信号。
图 4. 重症小鼠模型各组织的组织病理学检测 图注:9日龄BALB/c乳鼠腹腔注射104.5 TCID50 EV71毒株(NX10-147),3 dpi和5 dpi解剖取材,图片显示各组别的典型组织照片(×200),箭头指示5 dpi各组织典型病理变化,对照组小鼠组织未见明显病理变化。
图5. 免疫组织化学方法检测重症小鼠模型各组织中的EV71 VP2蛋白 图注:重症小鼠的骨骼肌、脊髓、脑干、肺以及空肠组织中可检测到阳性EV71抗原(棕黄色颗粒)(×200),在空白对照组的上述组织中未见阳性EV71抗原。
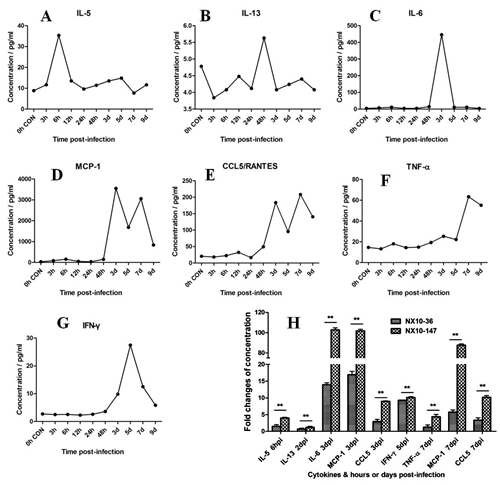
重症小鼠模型血清细胞因子检测 对重症小鼠模型进行血清细胞因子检测从血清细胞因子方面揭示重症发生机制。本研究采用CBA方法检测了重症小鼠的3、6、12 hpi 以及1、2、3、5、7、9 dpi的血清细胞因子IL-1β、IL-2、IL-4、IL-5、IL-6、IL-10、IL-13、TNF-α、IFN-γ,以及MCP-1、CCL5/RANTES的动态变化(图6)。结果发现,这些血清因子中,IL-5、IL-13、IL-6、MCP-1、CCL5、TNF-α在重症小鼠中发生某时间点的爆发性浓度增高,与空白对照组小鼠血清因子相比,发现重症小鼠血清爆发性增高的细胞因子分别是3 hpi重症IL-5上调4倍;48 hpi重症IL-13上调1.2倍;3 dpi重症IL-6、MCP-1都上调100倍以上;3 dpi和7 dpi重症CCL5/RANTES分别上调9倍和10倍;重症小鼠模型中的IFN-γ在5 dpi时达到峰值,重症为10倍;7 dpi重症TNF-α和MCP-1分别上调4倍和87倍。以上数据说明,IL-5和IL-13可能是EV71小鼠实验感染早期炎症反应的主要因素,并且细胞因子IL-6、TNF-α、IFN-γ、MCP-1、CCL5/RANTES在重症EV71实验感染的免疫病理损伤中发挥重要作用。
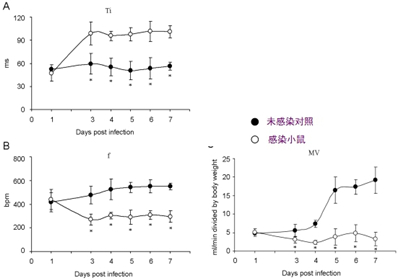
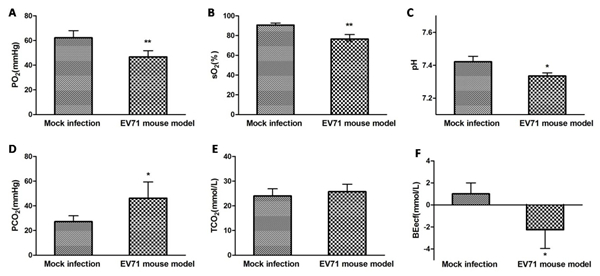
图6. 动态检测重症小鼠血清中的炎性细胞因子变化 图注:流式细胞小球微阵列术(CBA)检测血清中细胞因子浓度变化:A. IL-5; B. IL-13; C. IL-6; D. MCP-1; E. CCL5/RANTES; F. TNF-α; G. IFN-γ. 感染后出现因子浓度变化倍数比较显示在图H中。 EV71重症小鼠模型的气道阻力和血气分析 对小鼠的气道阻力进行分析,发现小鼠的吸气时间延长,呼吸频率降低,分钟通气量显著降低(图7),符合限制性通气不足的特征,可能是小鼠死亡的主要原因之一。 采用血气分析方法对EV71重症小鼠模型组和对照组小鼠的呼吸效果进行分析,与对照组相比,4 dpi感染组小鼠的氧分压(PO2)和氧饱和度(sO2)均明显下降,PO2 由62.2 mmHg下降到 46.75 mmHg,差异极显著(p < 0.01)(图8A);sO2由90.6 %下降到76.5 %,差异极显著(p < 0.01)(图8B),PO2和sO2的变化提示EV71重症模型组小鼠处于缺氧状态。并且发现二氧化碳分压(PCO2)和二氧化碳总量(TCO2)有所上升,PCO2由27.22 mmHg增加到46.25 mmHg,差异显著(p < 0.05)(图8D);TCO2由24.00 mmol/L 增加到25.75 mmol/L(图8E),PCO2的变化提示EV71重症模型组小鼠肺通气效果可能存在障碍。进一步发现了血液酸碱度pH值和细胞外液碱剩余(BEecf)均明显下降,pH值由7.42下降到7.33,差异显著(p < 0.05)(图8C);BEecf由1 mmol/L降低到–2.25 mmol/L,差异显著(p < 0.05)(图8F),提示重症模型组小鼠可能处于呼吸性酸中毒的状态。以上血气结果结合肺脏组织病理变化,说明EV71重症模型组小鼠肺脏通气功能低下,处于缺氧和呼吸性酸中毒的病理状态。
图7. 重症EV71小鼠模型的气道阻力分析
图8. EV71感染小鼠导致血液各项指标变化。 图注:4 dpi模型组和对照组小鼠血液中的(A) 氧分压PO2, (B) 氧饱和度sO2, (C)pH值, (D) 二氧化碳分压PCO2, (E) 二氧化碳总量TCO2, (F) 细胞外液碱剩余BEecf指标检测。 EV71小鼠模型超微病理学变化 对照组小鼠肌肉组织可见横纹明显,每条肌原纤维都可见清晰明带和暗带交替排列,肌质内含有丰富的线粒体、肌原纤维、高尔基复合体、溶酶体、糖原颗粒等肌浆内含物,糖原颗粒散在分布于肌原纤维间和肌浆中(图9A),肌细胞内可见清晰的线粒体,或在肌纤维间排列,其内外膜和嵴突结构清晰可见(图9B)。感染组小鼠肌肉组织超微病变明显,表现为肌组织横纹消失,明暗带模糊甚至消失,肌组织发生退行性变,细胞内出现水肿,部分肌原纤维发生溶解,肌质中的胞浆内容物减少,糖原颗粒甚至消失(图9C);线粒体肿胀、空化,基质电子密度降低,内室肿胀,嵴和膜结构模糊,嵴突变短减少,崩解消失,形成灶性空化(图9D);骨骼肌细胞核固缩,染色质边集,异染色质明显增多,发生变性、坏死。并且在肌纤维间可见巨噬细胞、中性粒细胞等炎性细胞浸润。 对照组脑组织中神经元胞浆中的细胞器丰富,内质网发达,平行或不规则排列,其间游离存在核糖体(图10A);线粒体丰富,散布于整个胞体中,线粒体内外膜和嵴突结构清晰(图10B);脑组织中有髓神经纤维髓鞘电子密度均匀(图10C)。感染组脑组织超微病变轻微,神经元细胞器丰富,内质网发达,线粒体丰富(图10D);神经元胞浆中可见少量空泡,部分线粒体内室肿胀(图10E);有髓神经纤维髓鞘发生层面分离,导致小泡性分离,呈现泡状改变(图10F)。 对照组脊髓前角神经元常染色质明显,异染色质少,细胞器丰富(图11A);脊髓前角神经元胞质中线粒体丰富,内质网发达(图11B)。感染组脊髓前角神经元中粗面内质网扩张,出现尼氏小体溶解,核周见微空泡形成;胞核皱缩,异染色质增多,细胞器减少,粗面内质网和高尔基复合体呈现不同程度的扩张,细胞质呈筛状外观,并伴随不同程度的多聚核糖体丢失,导致粗面内质网脱颗粒;线粒体肿胀,线粒体嵴突肿胀,嵴数量减少(图11C)。小胶质细胞包围吞噬神经元细胞,呈现嗜神经现象(图11D)。 对照组肺组织中I型上皮细胞扁平,其细胞核内可见呈浅亮的常染色质和呈深色颗粒状的异染色质,胞质少而薄,胞浆内可见少量细胞器,与周围细胞连接紧密(图12A);肺组织中的II型上皮细胞核大而圆,常染色质细密,异染色质少,粗面内质网、高尔基复合体、溶酶体等细胞器丰富(图12B);II型上皮细胞胞浆中可见清晰的特征性包含物——嗜锇性板层小体(图12C)。感染组肺组织中I型上皮细胞核中染色质边集,呈不规则堆积,并且与周围细胞之间连接松弛(图12D);肺组织中II型上皮细胞核形状不规则,染色质边集,核周细胞质电子密度降低,粗面内质网、核糖体、高尔基复合体等细胞器减少,胞质出现细小空泡变(图12E),嗜锇性板层小体或出现排空现象,溶酶体增多(图12F);肺泡壁中的细胞成分增多,其中肺泡II型上皮细胞增生,发生了间质性肺炎。
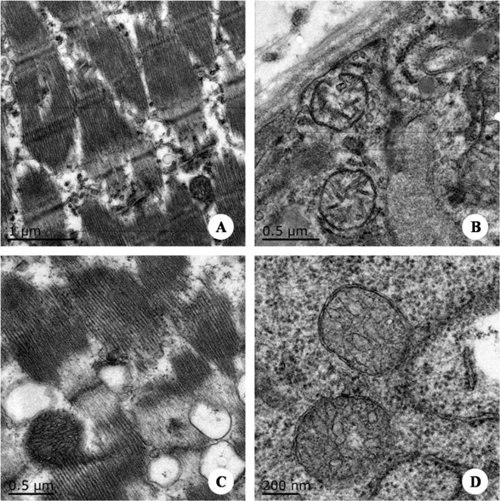
图9. 骨骼肌的超微病理变化 图注:A.对照组肌组织横纹明显,每条肌原纤维都可见清晰明带和暗带交替排列;B.对照组肌细胞胞浆内可见线粒体内外膜和嵴突结构清晰;C.感染组肌肉横纹消失,肌原纤维溶解,线粒体肿胀、空泡化;D.感染组肌组织线粒体肿胀,表现为内室肿胀,嵴和膜结构模糊。
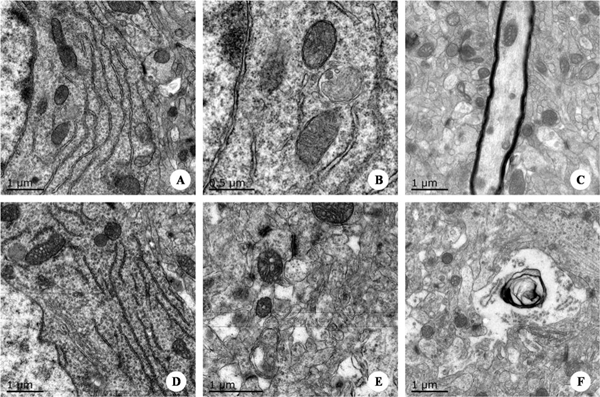
图10. 脑组织的超微病理变化 图注:A.对照组脑组织神经元细胞器丰富,内质网发达,线粒体丰富;B.对照组脑组织神经元中线粒体内外膜和嵴突结构清晰;C. 对照组脑组织中有髓神经纤维髓鞘电子密度均匀;D.感染组脑组织神经元细胞器丰富,内质网发达,线粒体丰富;E.感染组脑组织神经元胞浆中可见少量空泡,部分线粒体内室肿胀;F.感染组脑组织中有髓神经纤维髓鞘发生小泡性分离,呈现泡状改变。
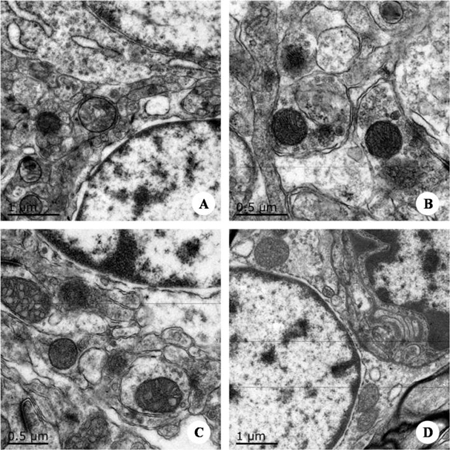
图11. 脊髓的超微病理变化 图注:A.对照组脊髓前角神经元常染色质明显,异染色质少,细胞器丰富;B.对照组脊髓前角神经元胞质中线粒体丰富,内质网发达;C.感染组脊髓前角神经元中线粒体肿胀,粗面内质网扩张,脱颗粒,尼氏小体消失,核周见微空泡形成;D.感染组中小胶质细胞包围吞噬脊髓前角神经元,呈现嗜神经现象。
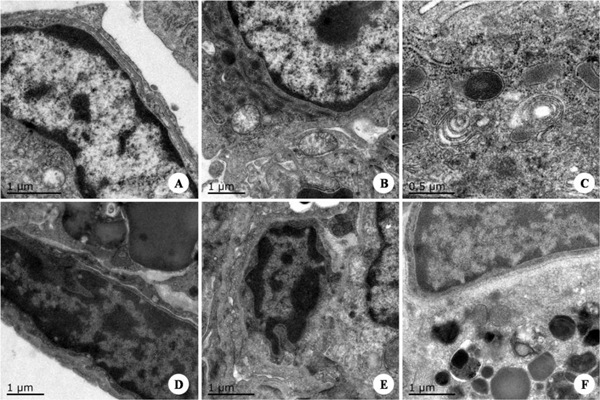
图12. 肺脏的超微病理变化 图注:A.对照组肺组织中I型上皮细胞扁平,可见常染色质和异染色质,可见少量细胞器;B.对照组肺组织中II型上皮细胞核大而圆,常染色质细密,异染色质少,细胞器丰富;C.对照组肺组织中可见清晰的嗜锇性半层小体;D.感染组肺组织中I型上皮细胞核中染色质边集,呈不规则堆积,与周围细胞之间连接松弛;E.感染组肺组织中II型上皮细胞核形状不规则,染色质边集,细胞器减少;F.感染组肺组织中的II型上皮细胞胞质细小空泡变,嗜锇性板层小体排空,溶酶体增生。 |
| 动物模型的评价与验证 | 重症EV71小鼠模型临床症状可随着感染时间增加,表现为竖毛、后肢瘫痪,甚至死亡。 |
| 保存方式 | |
| 合作方式 | |
| 相关文章 | |
| 备注 |


 京公网安备 11010502043083号
京公网安备 11010502043083号