| 标识符 | CSTR:16397.09.0H02000350 |
|---|---|
| 资源中文名称 | C9orf72基因敲除大鼠 |
| 资源英文名称 | SD. C9orf72 (TM )-GC/ILAS |
| 疾病概述 | 肌萎缩侧索硬化(ALS)也叫运动神经元病(MND),是一种累进性神经退行疾病,以控制肌肉收缩的上、下运动神经元选择性退化和凋亡为特征,引发瘫痪、最终导致死亡,患病率约为4-6/10万。大约10%的ALS病例是家族型的,90%是散发型的。从发现SOD1基因突变到现在,共确定了30余种致病基因,其中C9orf72,FUS,TARDBP,SOD1等比例较高,而EPHA4,ATXN2等20余种基因比率较低。肌萎缩侧索硬化症病因涉及兴奋毒性、氧化应激、神经营养因子、自身免疫、中毒、感染等,目前无有效的治疗方法,仍然是 “不治之症”。 已发现的30种致病基因和修饰基因与ALS的病理发生有关,其机制可归纳为细胞表面受体、RNA加工、蛋白质合成、能量代谢、内质网功能、轴突转运等几个方面的异常。其中C9orf72和EPHA4分别参与了RNA加工、内质网、细胞膜受体三种ALS的发病机制。 C9orf72蛋白与细胞运输和自噬有关,敲低斑马鱼的C9orf72表达可干扰神经分支的形成和缩短运动神经元轴突,推测C9orf72表达水平降低影响了神经元内细胞运输。 |
| 实验动物背景信息 | SD |
| 模型制作方法 | 基于CRISPR/Cas9技术建立C9orf72基因敲除大鼠,具体设计策略见图1A。 |
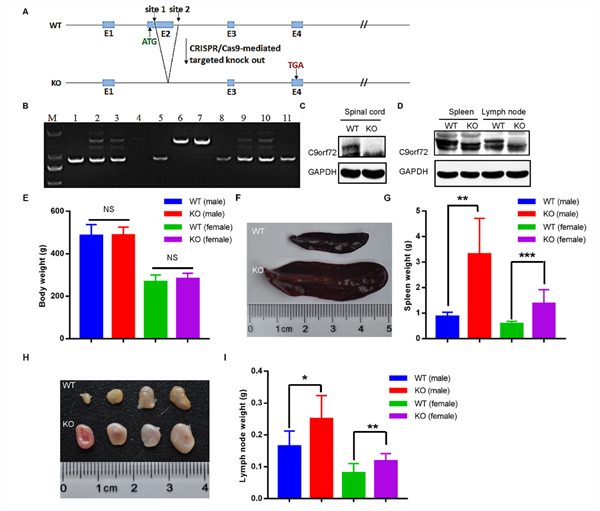
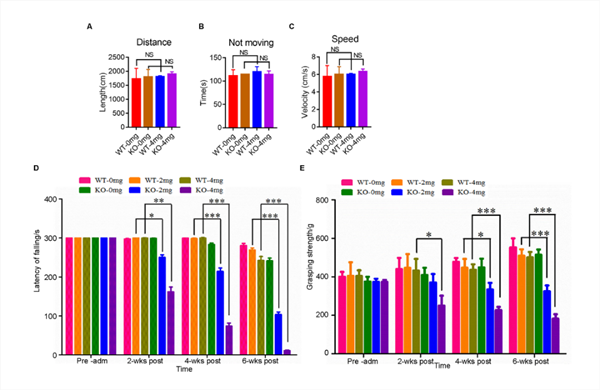
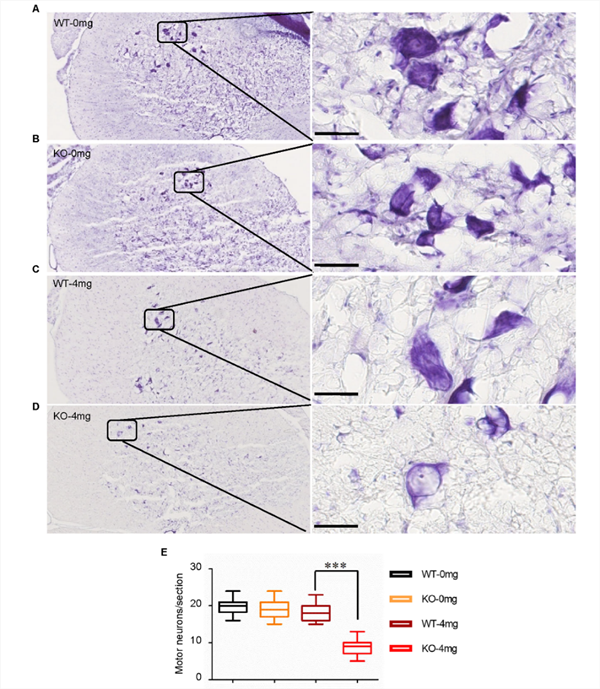
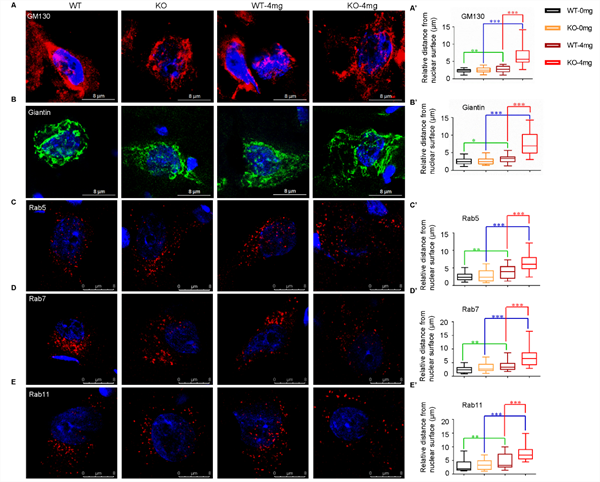
| 模型表型数据 | C9ORF72基因敲除大鼠的脊髓、脾和颈部淋巴结的C9orf72蛋白表达缺失,与野生大鼠相比,体重没有明显改变,但脾和颈部淋巴结发生明显的肿大(图1)。 初步研究发现,C9orf72敲除单独不足以诱发ALS表型。深入的,利用低剂量红藻氨酸(KA)皮下注射后,敲除大鼠出现进行性运动功能障碍(图2)、运动神经元的丢失(图3)和高尔基体脆性增加(图4)。提示C9orf72敲除大鼠需要额外的兴奋性毒性的刺激来诱发ALS。 C9orf72功能的丧失和兴奋性毒性协同作用是诱发ALS发病的重要因素。而在临床上,肌萎缩性脊髓侧索硬化症(ALS)的大多数病例中都发现了由兴奋性引起的运动神经元兴奋毒性的改变。作为一种可能的肌萎缩性脊髓侧索硬化症的常见介质,它可以与其他遗传因子相互作用,触发疾病的发病机制。
图1 C9ORF72基因敲除大鼠的建立
图2 C9ORF72基因敲除和兴奋毒性共同诱导运动缺陷
图3 C9ORF72基因敲除和兴奋毒性联合作用导致运动神经元丢失
图4 C9ORF72基因敲除和兴奋毒性联合作用导致运动神经元中高尔基复合体的脆弱性增加 |
| 动物模型的评价与验证 | C9orf72基因跟肌萎缩侧索硬化(ALS)有关,可以用来进行ALS发病机制的研究或者药物开发。 |
| 保存方式 | 冷冻 |
| 合作方式 | 不限定 |
| 相关文章 |
1. Dong, W., Ma, Y., Guan, F., Zhang, X., Chen, W., Zhang, L. * and Zhang, L. * (2021), Ablation of C9orf72 together with excitotoxicity induces ALS in rats. FEBS J., 288: 1712-1723. 2. 张丽, 张连峰*。肌萎缩侧索硬化症相关基因突变与疾病动物模型[J]. 中国比较医学杂志, 2017, 027(010):89-95. |
| 备注 |


 京公网安备 11010502043083号
京公网安备 11010502043083号