| 标识符 | CSTR:16397.09.0G02001123 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 资源中文名称 | SARS-CoV大鼠模型 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 资源英文名称 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 疾病概述 | 2002年在中国广东爆发的严重急性呼吸综合征(Severe Acute Respiratory Syndrome,SARS)波及全世界34个国家。2003年4月16日,世界卫生组织根据包括中国内地和香港地区,加拿大、美国在内的11个国家和地区的13个实验室通力合作研究的结果,宣布重症急性呼吸综合征的病因是一种新型的冠状病毒,称为SARS冠状病毒。 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 实验动物背景信息 | 大鼠包括SPF级Wistar大鼠、SPF级SD大鼠和SPF级Lewis大鼠。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 模型制作方法 | SARS-CoV病毒株为PUMC01(Sino-1, GenBank Acc. #; AY350750),分离自一个死于北京协和医院的典型的SARS患者(PUMCH)。SARS-CoV PUMC01病毒通过鼻腔喷雾方法感染动物。Wistar大鼠、SD大鼠和Lewis大鼠三个品系的动物,每个品系分成4周龄和7周龄两个年龄组,每个年龄组又根据感染病毒剂量的不同,分为高剂量组和低剂量组。动物安乐死后,取肺、脾、肝、肠淋巴结和血液样品进行病毒拷贝数和病毒滴度检测。感染后第7、14、21、28天检测SARS-CoV的IgG抗体动物安乐死后,取肺、肝、脾、肾和肠淋巴结组织进行病理检查。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 模型表型数据 | 1.大鼠感染后病毒在组织中复制情况
三个品系的大鼠分别在感染后第3,6,9,12、15、21和28天被处死,取肺、肝、脾、肾、血、肠系膜淋巴结,用病毒分离和RT-PCR方法检测病毒复制情况。Wistar和SD大鼠未检测到病毒。在感染Lewis大鼠的肺、肝、血中可以分离到病毒,以RT-PCR病毒检测结果判定,Lewis大鼠在感染后的12天之内,感染的24只大鼠均为阳性,感染率为100%,见表1。对照组病毒分离和RT-PCR的结果均为阴性。 表1 SARS-CoV3个品系大鼠中复制
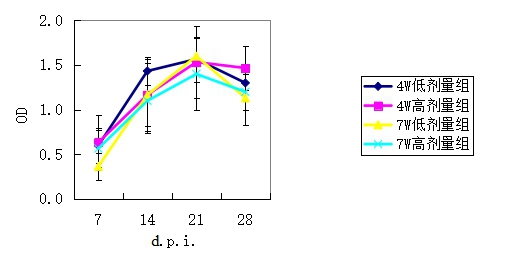
2.大鼠感染后血清中SARS-CoVIgG抗体水平 在感染后第7,14,21和28天检测抗SARS-CoV IgG抗体。在Wistar和SD大鼠中,在感染后第7天可以检测到抗SARS-CoV IgG抗体,在感染后第15-21天达到顶峰,在第28天后滴度开始下降。Lewis大鼠的抗SARS-CoV IgG抗体在感染后第28天仍然保持较高的滴度。4-7周龄Lewis大鼠抗体滴度随时间的变化见图2。对照组抗未检测到抗SARS-CoV IgG抗体。
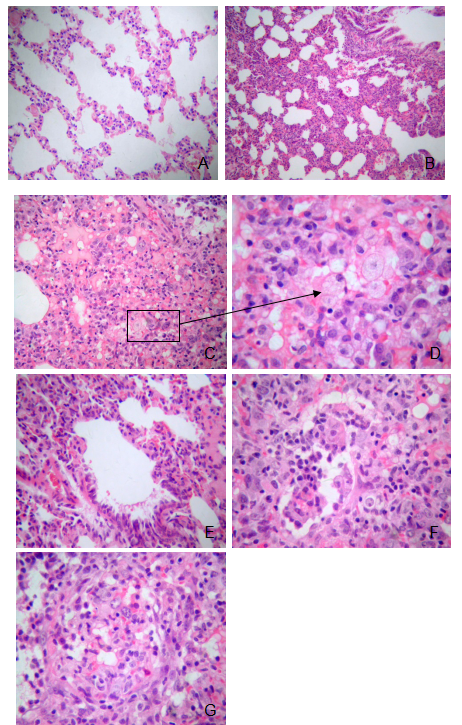
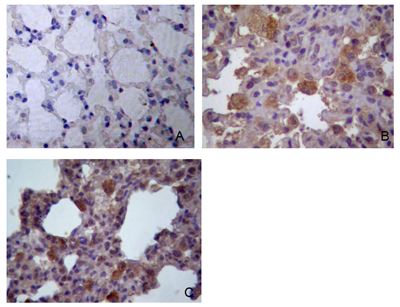
图2测定被感染Lewis大鼠血清SARS-CoVIgGOD值 3.大鼠感染后临床病理变化 实验组Lewis大鼠在感染SARS-CoV后出现嗜睡、食欲下降、体重减轻、毛发粗乱等临床症状。在Wistar和SD大鼠感染后第3,6,9,12、15、21和28天取肺、脾、肝等组织做病理学检查,未见明显的病理改变。在Lewis大鼠中,脾和肝脏未见明显的病理改变,在肺脏组织中可见明显的肺炎改变。感染Lewis大鼠第3天肺组织呈局限性间质性肺炎改变,表现为局部肺组织间隔增宽,血管充血伴多量以单核细胞和淋巴细胞为主的炎细胞浸润,肺泡腔内可见渗出物,肺泡上皮有坏死和脱落。感染第6~9天肺组织间隔明显增宽、融和伴多量炎细胞浸润,肺泡内可见明显的纤维素样渗出及出血,其中还可见较多的泡沫样组织细胞,有的小支气管、小血管周围可见多量炎细胞浸润,支气管腔内可见炎性渗出物,部分支气管上皮损伤脱落。感染第15天肺组织病变区域缩小,增厚的肺间隔内有多量泡沫样组织细胞浸润,未见出血及渗出。感染第21~28天肺组织病变区明显缩小,仅见少许淋巴细胞浸润,肺泡内渗出物消失,纤维结缔组织增生。肝脏及其它脏器未见明显病理变化。对照组动物各脏器未见明显的病理改变,见图2。 免疫组化染色的方法显示在感染后第3天和第12天的肺组织中可以检测到SARS-CoV抗原表达,对照组免疫组化结果阴性,见图3。
图2 Lewis大鼠肺组织病理变化。(A)正常对照(HE, 100×);(B)肺组织间隔增宽伴单核细胞和淋巴细胞浸润(HE, 100×);(C)和(D)间隔明显增宽,肺泡内可见泡沫样组织细胞(箭头所指) (HE, 100×和 400×).;(E)部分支气管上皮损伤脱落 (HE, 100×);(F)肺泡内可见明显的纤维素样渗出及出血 (HE, 200×);(G) 肺泡纤维化和增生 (HE, 200×)。
图3 Lewis大鼠肺组织免疫组织化学染色。(A)正常对照(100×); (B)大鼠感染后3天肺组织(200×) ;(C)大鼠感染后12天肺组织(200×)。
Wistar大鼠和SD大鼠的病毒复制和病理学改变也不明显,提示这些动物也不适合作SARS动物模型。Lewis大鼠对SARS-CoV敏感,有明显的病毒复制、特异性抗体产生和病理学改变。 尽管大鼠不是SARS-CoV的自然宿主,但Lewis大鼠在感染SARS-CoV后出现临床症状,包括嗜睡、食欲下降、体重减轻、毛发粗乱。肺组织病理学检查可见间质性肺炎改变。在感染后第3-12天可以在肺、肝和血中检测到病毒的复制,在感染后第7天左右产生抗体,并至少可持续4周。肺组织出现病理改变的时间基本上与抗体出现时间一致。SARS-CoV感染Lewis大鼠后出现临床症状和拟人SARS的病理改变,提示它可能是比猫、小鼠[23]、雪貂这些对SARS-CoV敏感的小动物更好的替代模型。Roberts et al报道了SARS-CoV感染金黄地鼠的情况,在感染的动物呼吸道发现了感染相关改变,但是肺组织没有出现明显的病理改变和SARS特异性IgG抗体。 Lewis大鼠对SARS-CoV比其它的小动物更敏感,以RT-PCR病毒检测结果判定,Lewis大鼠在感染后的12天之内,感染率为100%。Lewis大鼠作为研究SARS-CoV感染机制的模型, 具有比食蟹猴和恒河猴经济, 方便和易于操作的优点, 比小鼠[23]载毒时间长, 病理改变更明显。它可以作为继食蟹猴和恒河猴之后的SARS小动物模型。Lewis大鼠作为SARS小动物模型国际上没有相关报道,是我们首创的。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 动物模型的评价与验证 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 保存方式 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 合作方式 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 相关文章 | [1]朱华,高虹,邓巍等.SARS冠状病毒感染Lewis大鼠的实验研究[C].//中国实验动物学会第七届学术年会论文集.2006:170-174. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 备注 |


 京公网安备 11010502043083号
京公网安备 11010502043083号