| 标识符 | CSTR:16397.09.0C01000989 |
|---|---|
| 资源中文名称 | 新型冠状病毒再感染恒河猴模型 |
| 资源英文名称 | Rhesus Macaque Model of SARS-CoV-2 rechallenge |
| 疾病概述 | 2019冠状病毒肺炎(corona virus disease 2019,COVID-19),是由严重急性呼吸系统综合征冠状病毒(SARS-CoV-2)引起,以重症肺炎、呼吸衰竭为特征的传染性疾病。SARS-CoV-2病毒传染性强,自2019年12月在中国武汉出现后,快速在全球传播,引发全球大流行。截至2020年11月17日,SARS-CoV-2累计确诊感染人数超5542万,现有确诊人数超过1580万人,因COVID-19死亡达133万人。我国累计报告确诊病例92482例,死亡4749例。新型冠状病毒的传播严重影响了人们的正常生活,已成为全球关注的公共卫生和社会热点问题,新型冠状病毒肺炎的防控与治疗也是目前研究的热点。 |
| 实验动物背景信息 | 选用7只体重4-6 kg的3-5岁的SPF恒河猴(Macca mulatta)。实验前体检无异常,所有感染动物的实验必须在ABSL-3室中进行。 |
| 模型制作方法 | 1.实验材料:SARS-CoV-2病毒;选用体重4-6 kg的SPF恒河猴。实验前体检无异常,所有感染动物必须在ABSL-3实验室中进行。
2.气管途径SARS-CoV-2再感染恒河猴模型制作方法:每只动物经气管途径给予1毫升体积,106 TCID50 SARS-CoV-2病毒。待确定动物初次感染建立成功后,持续监测病毒载量和疾病表型,在所有动物疾病恢复后,即初次感染后28天,再次经气管途径给予1毫升体积,106 TCID50 SARS-CoV-2病毒,创建新冠病毒再感染恒河猴模型。
3.样本收集和检测:按照以下实验方案对动物进行监测和样本采集,记录体重、体温、临床体征;采集鼻/咽/肛拭子,测定病毒RNA;采集外周血,检测血液学和免疫细胞变化;胸片观察肺部病变情况;采集血清,进行特异性抗体检测,并在相应时间点进行安乐死和尸检,检测病毒组织分布及病理改变。
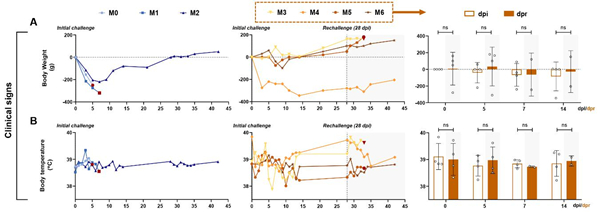
图1实验设计及样本收集 |
| 模型表型数据 | 1.临床指征变化情况:
在整个感染过程中,对体重、体温等临床特征进行观察。如图2A所示, 第一次SARS-CoV-2感染后,超过50%的猴子(4/7,M0、M1、M2和M4)的体重减轻了200至400克,然而所有猴子的直肠温度均未升高(0/7)。在感染后15天左右,感染猴的体重(M2 ~ M6)逐渐增加到正常范围(4/5,M4除外,图2A),直肠温度维持在正常范围内(图2B)。初次感染后,除M4之外,其余6只感染猴观察到短暂的食欲下降和/或呼吸频率增加。 在感染后28天,再次感染SARS-CoV-2,猴子表现出短暂的体温升高,这在初次感染期间是没有观察到的。
图2 新冠病毒再感染恒河猴模型临床指征的变化情况 2.病毒载量变化情况:
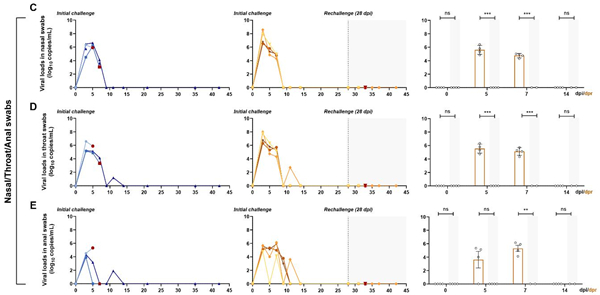
鼻拭子和咽拭子在感染后3天检测到病毒载量峰值(6.5 log10 RNA copies/mL),然后逐渐下降(图3C和3D)。肛拭子的病毒载量峰值(5 log10 RNA copies/mL)低于鼻拭子和咽拭子,也在感染后3 天观察到,然后呈线性下降,在感染后14天降至检测限之下(图3E)。在感染后15天左右,所有感染猴的鼻咽拭子和肛拭子的病毒载量均转为阴性。 再次感染SARS-CoV-2后,在鼻咽和肛拭子中病毒载量在2周内一直保持为阴性。
图3 新冠病毒再感染恒河猴模型鼻/咽/肛拭子病毒载量的变化情况 3.血液学变化情况:
在所有接受初次攻毒的猴子中,白细胞计数(3.5–9.5 × 109/L)、淋巴细胞计数(LYMP, 1.1–3.4 × 109/L)和中性粒细胞计数(NEUT, 1.8–6.4 × 109/L)均在正常范围内波动。与基线相比,初次感染后感染猴的WBC和LYMP有轻微但显著的降低(图4F)。 再次感染SARS-CoV-2后,血液学检测未观察到显著波动。
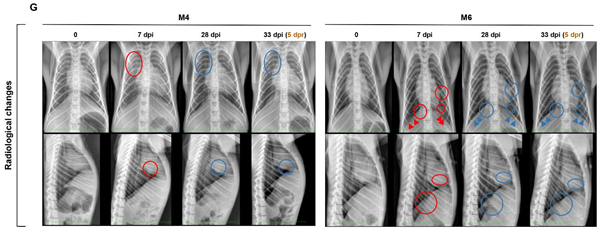
图4 新冠病毒再感染恒河猴模型血常规变化情况 4.影像学变化情况:
影像学检查发现双侧膈面模糊,肺部透明度降低,肺左下叶出现小斑影,提示感染猴出现肺炎,表现为中轻度至中度间质炎性浸润。在28 dpi时,胸部x光显示肺部恢复正常(以M4、M6为代表,图5G)。 再次感染后,M4、M6感染猴在33 dpi(5 dpr)影像学检测未见异常(图5G)。
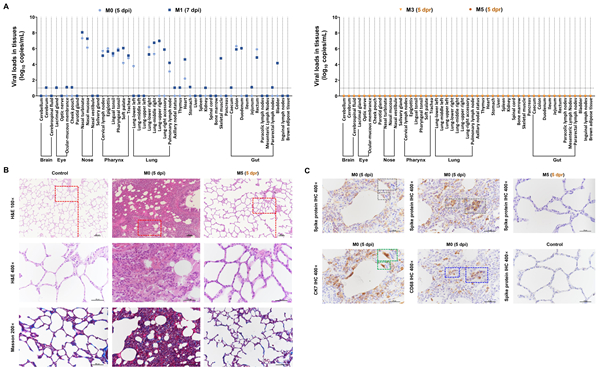
图5 新冠病毒再感染恒河猴模型影像学结果 5.组织分布及病理情况:
对感染猴进行安乐取材,M0(5 dpi)和M1(7 dpi)中检测到病毒RNA拷贝,主要集中在鼻(106–108 copies/mL)、咽部(104–106 copies/mL)、肺(103–107 copies/mL)和肠道(104–106 copies/mL)(图6A)。肺组织进行苏木精和伊红(H&E)染色,显示出轻度至中度间质性肺炎,表现为肺泡间隔增宽,肺泡间质巨噬细胞和淋巴细胞增多,肺泡上皮变性。此外,初次感染后的猴子肺部发现了浸润的炎症细胞。通过改良的马松染色, M0(5 dpi)和M1(7 dpi)感染猴增厚的肺泡间质中也可以观察到胶原纤维(图6B)。免疫组化发现病毒主要分布在肺泡上皮和巨噬细胞中(图6C),证实了SARS-CoV-2导致恒河猴COVID-19。 M3(5 dpr)和M5(5 dpr)在二次感染后未在组织中检测到病毒(图6A),同时肺部病理检查未见显著的病变及免疫细胞的炎性浸润。
图6新冠病毒再感染恒河猴模型病毒分布和病理变化的比较 6.免疫细胞变化情况:
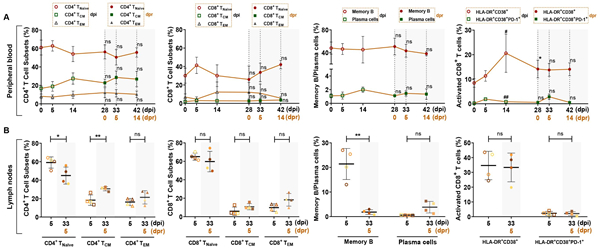
从外周血中检测T和B淋巴细胞的亚群,包括CD4 + T细胞亚群(CD4+ T naïve、CD4+ Tcm、CD4+ Tem), CD8 + T细胞亚群(CD8+ T naïve、CD8+ Tcm、CD8+ Tem),记忆B细胞和浆细胞。这些细胞在初次感染及再次感染后均保持稳定阶段。然而,与0 dpi相比,在14 dpi时观察到外周血中活化的CD8+ T细胞的百分比增加,同时在再次感染后(0 dpr)也发现了这一点(图7A)。对淋巴结中的免疫细胞进行检测,再次感染后5 天后淋巴结CD4+ Tcm细胞百分比较初次感染后5天高,CD4+ T naïve细胞和记忆B细胞百分比下降(图7B)。
图7新冠病毒再感染恒河猴模型免疫细胞的变化情况 7.抗体检测:
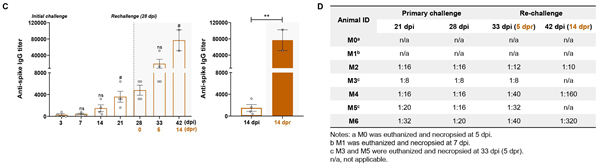
由于抗SARS-CoV-2特异性抗体水平逐渐升高,21 dpi时的抗体滴度明显高于3 dpi时,42 dpi(14 dpr)高于28 dpi(0 dpr)的抗体滴度(图8C)。此外,特异性抗体滴度在14dpr时远高于14dpi时(图8C,右侧)。重要的是,如图4D所示,中和抗体的平均滴度在再次感染后呈线性增强。
图8新冠病毒再感染恒河猴模型抗体的变化情况 |
| 动物模型的评价与验证 | 1、临床特征:定期检测动物的肛温,记录体重 2、病毒RNA测定:提取鼻、咽、肛拭子和组织中病毒RNA,进行逆转录,之后采用探针实时荧光定量RT–PCR方法测定拭子和组织中病毒载量。 3、血液学评价指标:EDTA抗凝管采集全血,使用血液学自动分析仪ProCyte Dx进行血液学分析。血液学参数包括总白细胞计数(WBC)、淋巴细胞计数(LYPM)和中性粒细胞计数(NEUT)。 4、免疫学评价指标体系:CD3 BV605、CD4 BV785、CD8 PE、CCR7 BV421、CD45RA APC、CD38 F |
| 保存方式 | |
| 合作方式 | |
| 相关文章 | [1]Deng W(#), Bao L(#), Liu J(#), Xiao C(#), Liu J(#), Xue J(#), Lv Q(#), Qi F, Gao H, Yu P, Xu Y, Qu Y, Li F, Xiang Z, Yu H, Gong S, Liu M, Wang G, Wang S, Song Z, Liu Y, Zhao W, Han Y, Zhao L, Liu X, Wei Q, Qin C*. Primary exposure to SARS-CoV-2 protects against reinfection in rhesus macaques. Science. 2020 Aug 14;369(6505):818-823. |
| 备注 |




 京公网安备 11010502043083号
京公网安备 11010502043083号