| 标识符 | CSTR:16397.09.0A01000823 |
|---|---|
| 资源中文名称 | 白消安诱导小鼠骨髓抑制模型 |
| 资源英文名称 | murine bone marrow injury model induced by busulfan |
| 疾病概述 | 骨髓抑制是指骨髓中的幼稚造血细胞活性下降。外周血的红细胞和白细胞都源于骨髓中的造血干细胞。外周血血细胞寿命短,常常需要不断补充。为了达到及时补充的目的,需要造血干细胞、造血祖细胞必须快速分裂。化学治疗(chemotherapy)和放射治疗(radiotherapy)以及许多其它抗肿瘤治疗方法,都是针对快速分裂的细胞,因而常常导致正常骨髓抑制。 |
| 实验动物背景信息 | C57BL/6J小鼠。 |
| 模型制作方法 | 1.实验小鼠 SPF级雄性C57小鼠35只,由北京华阜康生物科技股份有限公司提供[SCXK(京)2014-0004]。饲养于中国医学科学院医学实验动物研究所屏障环境动物房[SYXK(京)2015-0035],实验方案通过医学实验动物研究所实验动物管理和使用委员会(IACUC)审批,IACUC号为:MAM16003。动物实验经过福利伦理审查,符合3R原则。 2. 小鼠分组和给药 白消安(busulfan)购自于sigma。白消安粉末由DMSO配置为80mg/ml作为母液贮存,使用时用PBS稀释为所需浓度。小鼠分为对照组,低剂量给药组(20mg/kg)和高剂量给药组(40mg/kg),每组5只。腹腔注射,高剂量给药组分两天给药,每天给予20mg/kg。对照组小鼠给予等体积含5%DMSO的PBS作为对照。 3. 造血干细胞和造血祖细胞比例测定 分离的骨髓细胞,调整细胞浓度到1´ 107/ml,每只小鼠取100ul细胞用于后续染色。按体积比1:50加入biotin标记的混合一抗抗体CD4,CD8, B220,Ter119,Gr1,CD11b,均购自BD bioscience,4℃条件下孵育30min,PBS洗涤一次,离心条件为1400r/min,5min。离心后弃去上清,保持100ul体积,加入混合抗体Streptavidin(percp标记),scal-1(PE标记),ckit(APC标记),CD34(FITC标记),以上抗体均购自BD bioscience。4℃条件下孵育1h。之后PBS洗涤两次,离心条件如上。BD流式细胞仪(FACS AriaTMII,BD)检测造血祖细胞(Lin-c-kit+ Sca1-or LKS- cells),造血干细胞(Lin- c-kit+ Sca1+ or LKS+ cells),长期造血干细胞(CD34-Lin-c-kit+ Sca1+)在骨髓中所占的比例。 4.骨髓细胞计数 小鼠分组和给药方式如上述,白消安给药后15天小鼠CO2安乐死,75%酒精浸泡消毒,之后在无菌的条件下取小鼠单侧股骨,用含2%FBS的PBS缓冲液冲洗骨髓,将单侧股骨冲洗至2mLEP管中,保持体积为1ml,每只小鼠取10ul用于骨髓细胞计数。
5.粒细胞集落形成能力测定(colony forming unit-granulocyte and marchrophage, CFU-GM) CFU-GM实验通过检测粒细胞巨噬系细胞的集落形成能力,用来检测造血祖细胞分化为粒细胞巨噬细胞的能力。无菌取小鼠骨髓细胞,用PBS将小鼠骨髓浓度调整至4×105/ml,每个样加0.2ml 细胞至事先分装好的2ml M3534培养基中,振荡器充分混匀,静置2~5min,待气泡消失。加入24 孔板,每孔0.5ml。轻摇培养板,使培养基均匀分布。将培养板放入湿盒,置入37ºC,5%CO2 培养箱中。培养第7天在倒置显微镜下观察。低倍观察集落形成情况,细胞数≥50 为阳性集落。
6.外周血计数 用抗凝管收集外周血。自动血细胞计数仪(ABX pentra DX 120,法国)测定外周血中白细胞数(WBC)、红细胞数(RBC)、血红蛋白含量(HGB)和血小板(PLT)等指标。
7.单细胞集落能力检测 本方法依据前期发表文章[8, 9],分离的骨髓细胞,调整细胞浓度到1´ 107/ml,每只小鼠取100ul细胞用于后续染色。按体积比1:50加入biotin标记的混合一抗抗体CD4, CD8, B220,Ter119,Gr1,cd11b,4℃条件下孵育30min,PBS洗涤一次,离心条件为1400r/min,4℃,5min。离心后弃去上清,保持100ul体积,加入混合抗体Streptavidin(percp标记),scal-1(PE标记),ckit(APC标记),CD34(FITC标记)。4℃条件下孵育1h。之后PBS洗涤两次,离心条件如上。BD流式细胞仪(FACS AriaTMII,BD)分选长期造血干细胞(CD34-Lin-c-kit+ Sca1+)到提前加了100ul甲基纤维素培养基(Gibco MAM HS001)的96孔板中。每个孔两个细胞,待接种分选造血干细胞,37℃,5%CO2培养箱培养15天,低倍观察集落形成情况,细胞数≥50 为阳性集落,结果计算每组阳性孔比例。
8. 统计学分析 采用GraphPad Prism 5软件进行统计分析。计量数据以均数±标准差误(mean±SEM)表示,两组间比较采用t检验,多组间比较采用单因素方差分析(one-way AVOVA)和Tukey 多重比较法(Tukey's Multiple Comparison Test),重复测量数据采用重复测量数据方差分析方法。P<0.05差异有统计学意义。 |
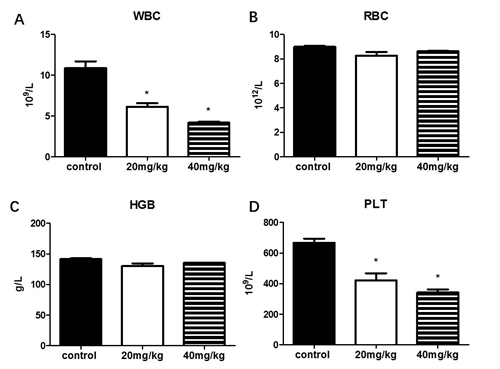
| 模型表型数据 | 1、白消安降低小鼠外周血计数 为探究白消安对小鼠骨髓抑制的影响,我们选取6-8周周龄的C57小鼠15只,体重为18-20g,随机分为三组,每组5只,分别为对照组,高剂量白消安组(40mg/kg)和低剂量白消安组(20mg/kg),给药后15天,检测小鼠的外周血计数。实验结果显示,给予白消安的小鼠外周血中WBC,PLT的数目与对照组小鼠相比显著降低,40mg/kg白消安给药组比20mg/kg白消安给药组降低更严重。外周血中的红细胞和血红蛋白数目各组间无显著性差异。实验结果表明,高剂量白消安和低剂量白消安均引起C57小鼠外周血中白细胞和血小板数目降低,损伤造血系统功能。高剂量组损伤程度更严重。
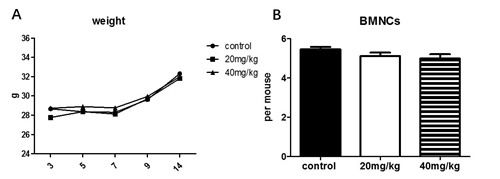
图1. 白消安对C57小鼠外周血计数的影响 C57小鼠接受低剂量和高剂量白消安给药,15天后用血细胞计数仪检测外周血中白细胞计数(A),红细胞计数(B),和血红蛋白计数(C),以及血小板计数(D)。结果means ± SE 表示,n=5。 2. 白消安对小鼠骨髓计数和体重的影响 观察给药对小鼠体重的影响,结果显示,与对照组相比,白消安给药组小鼠的体重未发现明显差异。小鼠体态正常,未发现弓背和萎靡的症状。小鼠骨髓细胞计数结果显示,给药后15天,给药组小鼠的骨髓有核细胞计数与对照组相比,未见明显变化。提示白消安对骨髓有核细胞数目无明显影响,或者给药15天后骨髓有核细胞有所恢复。
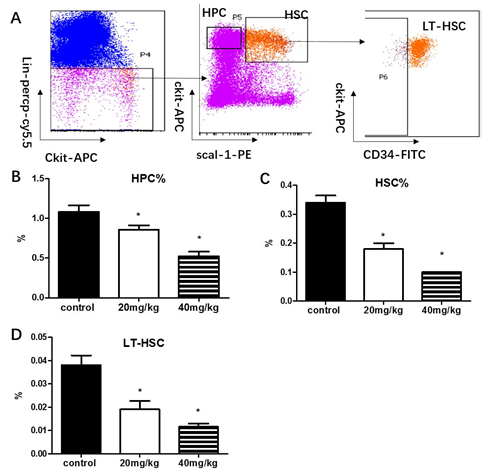
图2. 白消安对C57小鼠外周血和骨髓细胞计数的影响。C57小鼠接受低剂量和高剂量白消安给药,给药后不同时间段检测各组间小鼠体重变化(A),给药15天后检测小鼠骨髓有核细胞数(B)。结果means ± SE 表示,n=5, *p < 0.05。 3、白消安降低C57小鼠造血干细胞比例 为探究白消安对C57小鼠造血系统损伤作用,小鼠给药后15天,用流式细胞仪检测小鼠的骨髓细胞,流式门如图3所示。我们检测了造血祖细胞(lineage-scal-1-ckit+ ,HPC),造血干细胞细胞(lineage-scal-1+ckit+,HSC),长期造血干细胞(lineage-scal-1+ckit+CD34+,LT-HSC)的比例和数目。实验结果如图3.所示,给予低剂量白消安小鼠HPC,HSC,LT-HSC的比例与对照组小鼠相比分别下降20.84%(1.084±0.182 vs 0.858±0.122),47.05%(0.340±0.054% vs 0.180%±0.044%)和49.80%(0.038±0.009vs 0.019±0.008);给予高剂量白消安小鼠HPC,LSK,HSC的数目与对照小鼠相比分别下降51.84%(1.084±0.181 vs 0.522±0.132),70.59%(0.340±0.054 vs 0.100±0.001)和69.38%(0.038±0.009 vs 0.011±0.002)(P<0.05);以上的实验结果说明,表明白消安引起造血干细胞,造血祖细胞比例和数目显著降低,高剂量组与低剂量组相比损伤程度更加明显。
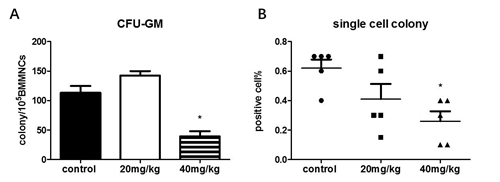
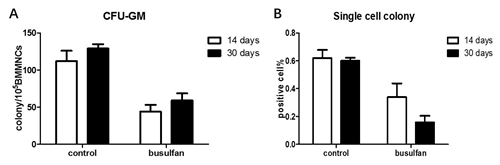
图3. 白消安对造血干细胞比例的的影响。C57小鼠白消安给药后15天,无菌取骨髓细胞流式细胞仪检测造血细胞分型。A.流式细胞仪分析时门的设置。B.造血祖细胞(lineage-scal1-ckit+,HPC)比例。C.造血干细胞(lineage-scal1+ckit+,LSK),细胞的比例。D.长期造血干细胞(CD34-lineage-scal1+ckit+,HSC)的比例。结果用means ± SE 表示,n=5。 4、白消安损伤小鼠造血细胞功能 为了检测白消安对C57小鼠造血系统功能的影响,分组和给药方式如上述,白消安给药后15天,检测粒细胞巨噬细胞集落形成能力。粒细胞巨噬细胞集落形成能力实验(colony forming unit –granulocyte and macrophage, CFU-GM),主要检测造血祖细胞分化为特定细胞群的能力。CFU-GM实验结果显示,小鼠接受低剂量白消安给药后,骨髓细胞的CFU-GM集落形成数与对照组相比没有统计学差异(113.3±28.05 vs 142.5±18.64,p>0.05),前期的研究结果显示,小鼠骨髓损伤后15天是小鼠损伤恢复期,虽然HSC和HPC的比例和数目依然显著低于对照组(如图4所示),但是CFU-GM的实验显示,造血祖细胞增殖抑制已经有所缓解。小鼠接受高剂量白消安给药后,骨髓细胞的CFU-GM集落形成数较对照组下降65.42%(113.3±28.05 vs 39.17±8.89,p<0.05)。差异均具有统计学意义。说明40mg/kg白消安可以显著诱导造血祖细增殖抑制。
图4. 白消安诱导C57小鼠造血干细胞和造血祖细胞增殖抑制。C57小鼠接受高剂量和低剂量白消安给药,15天后无菌取骨髓细胞,接种到甲基纤维素培养基(M3534,stemcell),接种后第七天检测CFU-GM。集落形成数≥50 个细胞群落为阳性克隆,统计105 BMCS中集落形成数目。流式细胞仪分选LT-HSC细胞到培养基中,第14天检测单细胞集落形成数目,结果用阳性孔在接种孔中比例显示。A.CFU-GM的数目。B.单细胞集落阳性率。结果用means ± SE 表示,n=5。 单细胞集落形成能力,利用造血干细胞接种在特定的培养基里,15天后集落形成能力评价造血干细胞的功能。实验结果显示,给与低剂量组白消安的小鼠单细胞集落形成能力与对照组相比降低33.81%(0.62±0.13 vs 0.41±0.23,p>0.05);而给与高剂量组白消安的小鼠单细胞集落形成能力与对照组相比降低58.06%(0.62±0.13 vs 0.26±0.15,p<0.05),表明40mg/kg白消安可以明显降低造血干细胞功能。 为了进一步确定白消安诱导造血干细胞损伤模型,我们进一步检测了给药15天和给药30天后造血祖细胞和造血干细胞的功能。实验结果显示,小鼠给予40mg/kg白消安,30天后外周血象和HSC和HPC的比例都有所恢复(结果未列出),CFU-GM的降低百分比与15天相比有所恢复(60.71% vs 54.26%),然而单细胞集落形成能力进一步降低(45.16% vs 73.80%)。说明随着时间的延长,白消安对骨髓造血干细胞的损伤进一步加剧。 图5. 给药后不同时间检测白消安对C57小鼠造血干细胞和祖细胞集落形成能力的影响。C57小鼠接受高剂量(40mg/kg)白消安给药,15天和30天后分别无菌取小鼠骨髓细胞,接种到甲基纤维素培养基(M3534,stemcell)和干细胞增殖培养基中,接种后第7天检测CFU-GM,第14天检测造血干细胞单细胞集落形成能力。CFU-GM结果为105 BMCS中集落形成数目。单细胞集落形成能力以阳性细胞占接种细胞比例表示。A.CFU-GM的数目。B.单细胞集落阳性率。结果用means ± SE 表示,n=5。 |
| 动物模型的评价与验证 | |
| 保存方式 | |
| 合作方式 | |
| 相关文章 |
1.李程程, 管博文, 苏路, 党女, 王玉全, 孟爱民. 白消安对小鼠造血干细胞功能的损伤作用[J]. 中国比较医学杂志, 2018, 28(2):26-32 2.党女,卢延华,管博文,孟爱民. 白消安对2型糖尿病 KKAy小鼠外周血细胞及骨髓细胞的影响[J]. 中国比较医学杂志, 2020, 30(1):45~50. |
| 备注 |


 京公网安备 11010502043083号
京公网安备 11010502043083号