| 标识符 | CSTR:16397.09.0I01000712 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 资源中文名称 | IFITM6敲除小鼠_ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 资源英文名称 | IFITM6 gene knockout mice | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 疾病概述 | 固有免疫是机体防御外来病毒感染的第一道防线,通过识别病原并产生各种细胞因子、趋化因子、干扰素(IFN)等多种抗病毒因子。干扰素诱导的跨膜蛋白(IFITM家族),是一类具有抗病毒作用的ISG(干扰素诱导基因)的编码产物,并证明其在多种生物过程中发挥作用,具有广泛的抗病毒作用,并在免疫信号转导、细胞归巢等发挥作用。 IFITM家族包括IFITM1、IFITM2、IFITM3、IFITM5、IFITM6、IFITM7和IFITM10,除了IFITM5特异性表达与骨细胞,不依赖与IFN的表达,其余家族在IFN的调控下在多组织和器官广泛表达。其中,FITM1、IFITM2、IFITM3、IFITM5和IFITM10在人类中表达,FITM1、IFITM2、IFITM3、IFITM5和IFITM6在小鼠中表达(图1)。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 实验动物背景信息 | 实验所用小鼠(C57BL/6)背景。C57BL/6小鼠也被称为C57 black 6,也称作B6。1921年被培育出来,属于近交品系。该品系的最主要的两个特点就是品系稳定和易于繁殖。主要用途包括:作为生理学与病理学的实验动物模型、构建转基因动物模型、作为产生自发突变和诱发突变的同基因型小鼠的背景品系。该品系在国内使用频率高,价格相对便宜。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 模型制作方法 | 3.1 实验材料 3.1.1 实验动物 C57BL/6购自北京维通利华实验动物技术有限公司 SCXK(京)2016-0006。超排用雌鼠数量10-15只,年龄3周龄,交配传代用野生型鼠为成年8-10周龄小鼠。实验中基因工程小鼠由本实验室繁殖产生。实验中涉及动物的操作程序已获得中国医学科学院医学实验动物研究所实验动物使用与管理委员会的批准,批准号为ZLF18004.
3.1.2实验仪器
3.1.3实验试剂
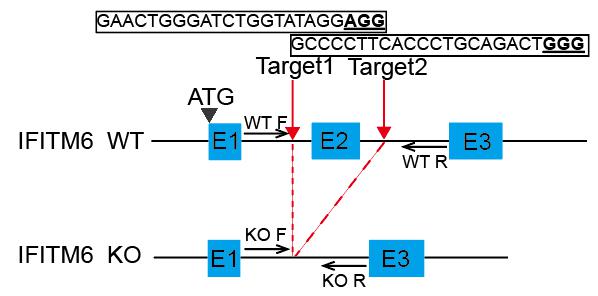
3.1.4模型构建流程 利用CRISPR/Cas9技术制备IFITM6敲除小鼠。选择敲除第二外显子,来构建IFITM6敲除小鼠 (B6. IFITM6 (tm)-GC/ILAS)。该基因敲除的杂合子小鼠,相互杂交可以获得该基因敲除的纯合子小鼠,使用PCR方法进行基因型鉴定。 3.1.5 IFITM6敲除小鼠的建立 3.1.5.1 IFITM6敲除小鼠模型的建立 (1)设计方案
图 1.IFITM6敲除小鼠模型构建设计方案 (2)构建sgRNA 载体pUC57-sgRNA expression vector,根据基因信息选择靶点并合成sgRNA。
靶点1: M- Ifitm6-EA1-g-up: TAGGACTGGGATCTGGTATAGG M- Ifitm6–EA1-g-down: AAACCCTATACCAGATCCCAGT
靶点2: M- Ifitm6-EB1-g-up: TAGGGAGAATGCCCAGGGATTC M- Ifitm6–EB1-g-down: AAACGAATCCCTGGGCATTCTC合成的sgRNA单链通过退火复性结合成小片段,插入BSA I线性化的载体,构建完成的sgRNA载体通过体外转录成为可注射的sgRNA。 (3)构建Cas9载体pST1374-NLS-flag-linker-Cas9,载体通过体外转录成为可注射的Cas9-RNA。
(4)显微注射
1)超数排卵:10-15只3周龄雌鼠注射激素进行超排。
2)受精卵注射:取约120枚受精卵进行注射。
3)受体鼠制备:8-10周龄雌鼠与结扎的SD雄鼠交配后选取见栓的雌鼠。
4)胚胎移植:将注射后的受精卵移植到受体鼠输卵管壶腹部(移植一次,120枚卵,5只受体鼠)。
(5)基因型鉴定
1)剪尾编号:出生7-10天的乳鼠,剪取脚趾和尾尖进行编号及取材。
2)基因组DNA提取:使用基因组DNA提取试剂盒提取基因组DNA
3)PCR检测:根据序列信息设计检测引物并进行PCR检测。
(6)结果分析:选取通过PCR检测后含有不同于野生型分子量条带的鼠号,将PCR产物进行TA克隆,之后用检测引物进行菌液PCR,筛选有插入的克隆测序。
(7)根据测序结果确定IFITM6敲除小鼠模型(B6. IFITM6 (tm)-GC/ILAS)用于后续实验。
3.1.5.2 动物繁殖和表达图谱分析 获得F0代后,首先通过与野生型鼠进行杂交,进行基因修饰鼠传代能力分析。获得能够传代的杂合子小鼠进行相互杂交,产生纯合敲除小鼠并用于后续实验。
图 2. IFITM6敲除小鼠的繁育
3.1.5.3 鼠尾基因组DNA提取 在幼崽出生后剪脚趾标记,收集幼崽脚趾至1.5 mL EP管。然后参照DNA提取试剂盒(全式金)说明书按以下程序操作。 (1)加入100 μL LB2和20 μL Proteinase K,55℃摇床孵育至完全裂解。
(2)12000 rpm 离心5 min,转移上清于一无菌的离心管中。
(3)加入500 μLBB2,立即涡旋5 s,室温孵育10 min。
(4)将全部的溶液加入离心柱中,8000 rpm离心1 min,弃掉流出液。
(5)加入500 μL CB2溶液,12000 rpm离心1 min,弃掉流出液。
(6)重复步骤(5)一次。
(7)加入500 μL WB2(使用前加入88 mL无水乙醇),12000 rpm 离心1 min,弃掉流出液。
(8)重复步骤(7)一次。
(9)10000 rpm 离心2 min,彻底去除残留的WB2。
(10)将离心柱置于一干净的离心管中,开盖静置5 min,在柱的中央加入50~200 μL预热EB(60℃~70℃),盖上盖子,室温静置3 min,12000 rpm 离心2 min,洗脱DNA。保存至4℃冰箱。
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
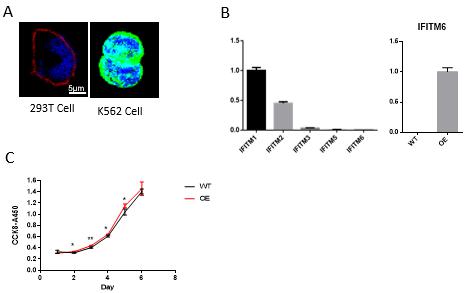
| 模型表型数据 | 4.1 IFITM6主要定位于细胞膜上 构建过表达IFITM6-Flag质粒,转染293T细胞,通过用抗Flag抗体进行免疫荧光染色,结果表明IFITM6主要定位于细胞膜上(图3A)。并对K562细胞中家族其他基因分析,发现IFITM1和IFITM2表达相对较高(图3B),IFITM6过表达影响细胞增殖(图3C)
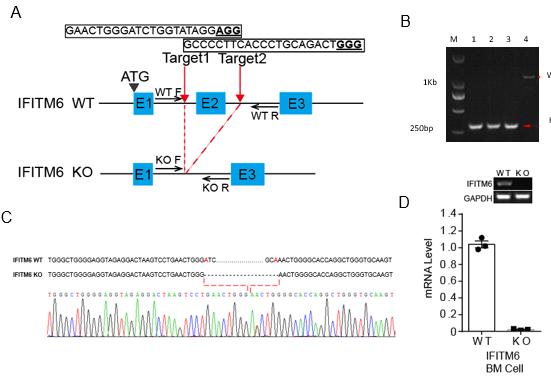
图3所示 在K562细胞中过表达影响细胞增殖 4.2 IFITM6敲除小鼠的建立 利用CRISPR/Cas9在IFITM6基因第二外线子选择gRNA靶点,敲除第二外显子。出生的小鼠经过设计包含靶点的引物(Table1),进行基因型鉴定,并进行插入序列的测序,最终获得了敲除第二外显子的小鼠,如图3-a所示。随后,我们通过杂合子杂交的方式获得了纯合敲除小鼠,并进行了表达分析,图3-c显示。结果表明我们成功建立了该基因的敲除小鼠模型。
图3 IFITM6敲除小鼠的建立
Table 1 本文中用于基因型鉴定的引物信息
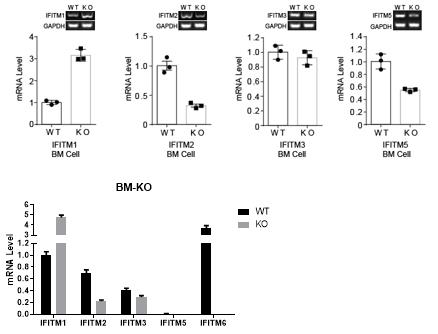
4.3 IFITM6敲除对家族其他成员的影响 我们分析了IFITM6敲除对家族其他成员的影响,结果表明IFIMT6敲除小鼠中,IFITM1表达升高,IFITM2和IFITM5表达下降,IFITM3表达变化不明显(图4所示)。
图4 IFIMT6敲除对IFIMT家族其他成员表达的影响
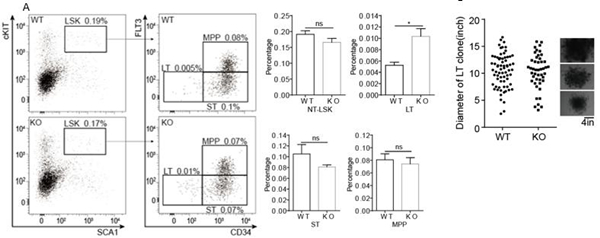
4.4 IFITM6敲除影响LT-HSC 我们对该基因的敲除小鼠进行了造血干细胞分化、发育相关的流式分析,结果表明基因缺失对LSK影响不明显,但对LT-HSC有促进作用,但是LT单克隆培养实验发现,敲除后会造成克隆形成数减少,但不影响克隆大小和形态(图5所示)。
图5 IFITM6敲除影响HSC功能
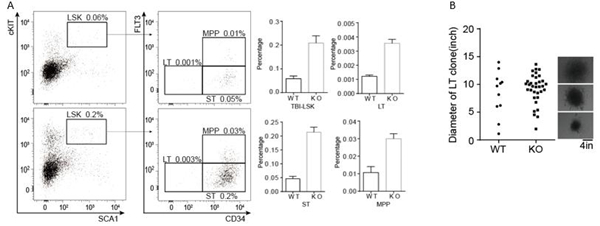
4.3 IFITM6敲除在辐射引起的损伤(TBI)中起保护作用 我们对该基因敲除小鼠进行了辐射引起的损伤(TBI)实验,结果显示IFITM6敲除在TBI实验中起保护作用,并且克隆形成能力明显增加(图5所示)。
图6 IFITM6敲除在TBI实验中起保护作用
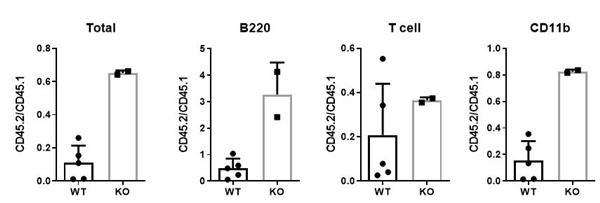
4.5 IFITM6敲除影响骨髓竞争性移植 我们通过竞争性移植实验,初步分析发现,IFITM6敲除在竞争性移植中起保护作用(图7所示)。由于动物目前数量较少,需要进一步增加动物数量进一步核实。
图7 竞争性移植实验 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 动物模型的评价与验证 | 5.1基因型鉴定 该模型鼠是通过CRISPR技术,将IFITM6的第二外显子敲除,,因此,在基因水平鉴定,需要区分野生型、杂合子和纯合子,鉴定引物为Table1中所列。 5.2 基因表达情况 对敲除鼠组织取材,通过Q-PCR检测检测不到IFITM6基因的表达。 5.3 过表达K562细胞增殖的影响 该基因的表达主要定位于细胞膜上,过表达会影响K562细胞的增殖。 5.4 在TBI中的作用 该基因敲除在TBI引起的造血干细胞损伤过程中起保护作用。 5. 5 该基因敲除对竞争性移植的 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 保存方式 | 活体繁殖 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 合作方式 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 相关文章 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 备注 |


 京公网安备 11010502043083号
京公网安备 11010502043083号