| 标识符 | CSTR:16397.09.0I01000826 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 资源中文名称 | 辐射诱导Fox3a缺陷小鼠造血系统损伤模型 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 资源英文名称 | Irradiatoin-induced hematopoietic injury model of Fox3a deficient mouse | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 疾病概述 | 人体受到辐射事故照射或者肿瘤患者放射治疗时,造血系统是辐射损伤敏感的靶器官。在接受到亚致死剂量照射后,不仅出现急性放射病,表现为全血下降、出血、感染等急性骨髓抑制表现;急性损伤的救治主要是细胞因子提高造血能力及支持疗法。部分患者经过治疗后还会出现远期损伤,表现为持续性骨髓抑制,由于起病隐匿,没有有效治疗方法,预后不良。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 实验动物背景信息 | FVB/N及C57BL/6J 的FOXO3A-/-小鼠,由中国医学科学院医学实验动物研究所张连峰教授课题组提供。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 模型制作方法 | (一)实验材料
1.实验动物 FOXO3A基因敲除FVB/N小鼠(FOXO3A+/-)由中国医学科学院医学实验动物研究所张连峰教授课题组保存(store number:016132-UCD),雌性小鼠4只,SPF级,体重16~18g,5周龄;野生型雄性FVB/N小鼠2只,SPF级,体重16~18g, 5周龄,由北京维通利华实验动物技术有限公司提供[SCXK(京)2016-0011]; FOXO3A基因敲除C57BL/6J小鼠(FOXO3A+/-)由中国医学科学院医学实验动物研究所张连峰教授课题组通过CRISPR/Cas9基因编辑技术制备,雌性小鼠5只,SPF级,体重15g,4周龄;野生型雄性C57BL/6J小鼠5只,SPF级,体重18~20g, 6~8周龄,由北京华阜康生物科技股份有限公司提供[SCXK(京)2014-0004]。实验方案通过中国医学科学院医学实验动物研究所实验动物管理和使用委员会(IACUC)审批,IACUC号为:MAM17002。实验动物饲养繁育和实验过程中,在不影响实验要求和实验结果的基础上,严格按实验动物使用的3R原则(减少、替代、优化)关注实验动物福利。 2.试剂与仪器
EDTA-K3购自Sigma公司,甲基纤维素培养基购自Stem cell Technologies公司,流式抗体CD4、CD8、B220、Ter119、Gr-1、CD11b、Streptavidin、scal-1、ckit均购自BD Bioscience和 eBioscience公司;X-RAD 225高能量生物学X射线辐照仪(美国), FACS Aria TMⅡ流式细胞仪(BD Bioscience), DX120全自动血液分析仪(ABX PENTRA), CKX41倒置显微镜(奥林帕斯)。
(二)实验方法 1. 小鼠分组和照射 小鼠均分为四组:野生型小鼠对照组(WT组),FOXO3A-/-小鼠对照组(FOXO3A-/-组),野生型小鼠照射组(WT+IR), FOXO3A-/-小鼠照射组( FOXO3A-/-+IR),分别接受假照射和4Gy X-线全身照射(TBI),照射剂量率为0.9Gy/min。接受TBI小鼠于SPF级动物房中饲养,每天观察记录体重变化。 2 小鼠外周血常规检测 小鼠TBI 后14d小鼠眼眶静脉丛取血,抗凝管收集外周血,全自动血液分析仪测定外周血中白细胞数(WBC)、红细胞数(RBC)、血红蛋白含量(HGB)和血小板(PLT)等指标。 3 小鼠胸腺、脾脏指数测定 小鼠TBI 后14d称重安乐死,取胸腺、脾脏并称重,计算脏器指数,脏器指数=脏器(mg)/体重(g)。 4 骨髓细胞有核细胞计数 小鼠TBI后14d,无菌分离小鼠胫骨和股骨,剔除肌肉,注射器冲洗骨髓细胞,过滤后采用KOVA一次性计数板,显微镜下人工骨髓计数。最终细胞计数结果以每只小鼠×107个细胞表示。 5 小鼠骨髓细胞表型分析 小鼠TBI后14d,收集骨髓细胞至流式管,加入Biotin标记的混合一抗抗体(CD4、CD8、B220、Ter119、Gr1、cd11b),孵育后洗涤并重悬细胞,加入混合二抗抗体streptavidin(percp标记)、scal-1(PE标记)、ckit(APC标记),孵育后洗涤并重悬细胞。流式细胞仪检测HPCs(Lin− c-kit+ Sca1−or LSK- cells),HSCs(Lin− c-kit+ Sca1+or LSK+ cells)[19]在骨髓中所占的比例。 6 粒细胞巨噬细胞集落形成单位(Clony forming unit-granulocyte and macrophage,CFU-GM)测定[6] 小鼠TBI 后14d安乐死,分离骨髓细胞并分组混合,每组接种40000个细胞到分装好的2ml的3534培养基中。按操作说明进行后续接种。接种细胞培养5~7d后于倒置显微镜下读取CFU-GM数,细胞数≥50为阳性集落。结果换算为每105个BMNCs中CFU-GM的个数。 7 统计学方法 对数据进行分析方差分析(ANOVA)。组间方差分析比较时,使用用于多重比较的the Student–Newman–Keuls test。两组计量资料比较时使用非配对Student's t 检验,差异P<0.05时认为具有统计学意义。所有这些分析使用GraphPad Prism软件(San Diego,CA,USA)。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 模型表型数据 | 1. FOXO3A缺陷小鼠受照后外周血计数检测 FOXO3A缺陷小鼠接受4Gy TBI,2w后全自动血液分析仪测定外周血,发现白细胞数(WBC)、红细胞数(RBC)、血红蛋白含量(HGB)、血小板(PLT)下降,与野生型小鼠变化没有差异(见表2)。 表1 FOXO3A缺陷小鼠受照后外周血计数检测 (
a:与WT组相比,P<0.05;b:与FOXO3A-/-组相比,P<0.05。
2.FOXO3A缺陷小鼠受照后骨髓细胞计数检测
FOXO3A缺陷小鼠接受4Gy TBI,2w后检测单侧骨髓细胞计数,发现FOXO3A缺陷小鼠低于野生型对照小鼠;受照后FOXO3A缺陷小鼠骨髓细胞计数下降幅度低于野生型对照(见表2)。 表2 FOXO3A缺陷小鼠受照后骨髓细胞计数检测 (
a:与WT组相比,P<0.05。 3.FOXO3A缺陷小鼠免疫脏器系数
FOXO3A缺陷小鼠免疫脏器系数与野生型对照未见差异;受照后改变未见差异(见表3)。 表3 FOXO3A缺陷小鼠免疫脏器系数(
a:与WT组相比,P<0.05;b:与FOXO3A-/-组相比, P<0.05。
4.FOXO3A缺陷小鼠骨髓细胞分型检测
骨髓细胞分型检测发现,FOXO3A缺陷小鼠体内HPCs 比例升高;接受4 Gy X 射线TBI 后14 d,FOXO3A-/-受照小鼠出现HSCs、HPCs 比例和数目下降程度,高于野生型对照。 表4 FOXO3A缺陷小鼠骨髓细胞分型检测(
a:与WT组相比,P<0.05;b:与FOXO3A-/-组相比,P<0.05; c:与WT+IR组相比,P<0.05。 5.FOXO3A缺陷小鼠造血祖细胞增殖功能测定
CFU-GM检测发现FOXO3A缺陷小鼠造血祖细胞增殖能力与野生型对照没有差异;接受4Gy X 射线TBI 后14 d, FOXO3A缺陷小鼠未见明显降低(见表5)。
表5 FOXO3A缺陷小鼠造血祖细胞增殖功能测定(
a:与WT组相比,P<0.05; c:与WT+IR组相比,P<0.05。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 动物模型的评价与验证 | 评价该动物模型中采用的生理、生化和病理方法,包括行为、影像、生理生化和组织切片等技术方法及评价模型成功的指标进行详细介绍。采用的仪器设备应满足模型评价的要求,指标完善,条件稳定。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 保存方式 | 冷冻保存 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 合作方式 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 相关文章 |
1.王玉全,李程程,苏路路,管博文,卢延华,孟爱民,樊飞跃. FOXO3A基因敲除小鼠繁殖鉴定及骨髓造血干细胞表型初步分析[J].中国比较医学杂志,2019,29(01):41-46. 2.王玉全,李程程,苏路路,管博文,卢延华,关菲菲,荣利,王小春,孟爱民,樊飞跃. FOXO3A对全身照射小鼠造血系统辐射损伤的影响[J].中国比较医学杂志,2019,29(9):10~16. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 备注 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


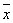 ±s,n=6)
±s,n=6) 京公网安备 11010502043083号
京公网安备 11010502043083号