| 标识符 | |
|---|---|
| 资源中文名称 | Zika病毒感染小鼠模型 |
| 资源英文名称 | Zika virus infected mice model |
| 疾病概述 | Zika病毒类似于其它黄病毒,基因组为单股正链RNA ,全长约10800nt 。Zika病毒基因组两端为 3’和 5’非编码区(Untranslated Regions, UTRs),中间为编码区只有一个开放阅读框架 (Open Reading Frame , ORF) 以多顺反子的形式表达一个多聚蛋白在宿主蛋白酶的作用下分解为3个结构蛋白(衣壳蛋白 (Capsid, C)、前膜蛋白 (Precursor membrane), 和包膜蛋白 ( Envelope, E))和 7 个非结构蛋白(Non structural ) (NS1, NS2A, NS2B, NS3, NS4A, NS4B,和NS5)。Zika病毒通过挟持宿主内质网(Endoplasmic Reticulum,ER)和高尔基体Golgi Complex,GC的膜结构形成囊泡,为其基因组复制提供附着点。Zika病毒借助宿主的翻译系统完成结构蛋白和非结构蛋白的表达,并在囊泡上完成组装。未成熟病毒通过出芽的方式从内质网释放到细胞质,通过囊泡运输到达高尔基体,在高尔基体内 PrM 蛋白在宿主蛋白酶的作用下分解为Pr和M病毒成熟,通过细胞出泡的方式释放,进入下一个病毒生命周期。 |
| 实验动物背景信息 | BALB/c小鼠(BALB/c Mouse) BALB/c为近交系小鼠,遗传背景一致,微生物背景可控,个体间相似度高,易于操作;小鼠相关的免疫球蛋白、细胞类型、细胞因子等试剂己商品化,费用和饲养要求低。 |
| 模型制作方法 | 1. 实验环境 生物安全实验室3级:参照2013年4月2日卫计委专家对新发Zika病毒生物安全评估会议指南暂定Zika病毒属于三类。将Zika动物实验在生物安全三级实验室内进行。已被我国列为按甲类传染病管理的乙类传染病,对其病原体和动物感染实验的操作应该在ABSL-3实验室中进行。
2. 实验材料 1)毒株:Zika毒株(ZKC2/2016); 2)实验动物:SPF 8周龄雌性及雄性 BALB/c小鼠; 3)试剂:DMED培养液,RNeasy Mini Kit(QIAGEN,74106)等 4)实验仪器: 微型离心机(EASTWIN6000) 高速冷冻离心机(KUBOTA3500) 电动研磨器(德国IKA-T10) 倒置显微镜(Nikon) 实时荧光定量检测系统(ABI) 二氧化碳培养箱(Thermo371) 生物安全柜
3. 实验操作规程 3.1 动物的饲养与繁育 1)伦理申请:按照实验动物伦理要求向北京协和医学院医学实验动物研究所动物使用和伦理委员会提交实验动物使用申请表。并获得批准(批准号:ILAS-BLL17007)。 2)小鼠饲养:8周龄SPF级雌性及雄性BALB/c小鼠均饲养于SPF级独立通风屏障系统中,饲养房间温度24-26℃,每天光照约14h。动物自由饮水取食。大约每周换3次垫料。 3)BALB/c小鼠的繁育:每笼放8周龄SPF级雌性及雄性各一只,每日上午观察雌鼠的阴道栓塞。见阴道栓塞后将雄性小鼠方另一单笼饲养备用。分笼后需给母鼠添加生长繁殖饲料,大约18日后每日上午10点左右观察怀孕母鼠的生育情况。规定每天观察的生育的小鼠为0.5天;如有其他情况在10点以后观察到小鼠妊娠或妊娠完成,记作第2天生育乳鼠。初生24-36h的乳鼠用于Zika病毒攻毒。
3.2 ZKC2/2016病毒的传代 1)防护:涉及Zika病毒活病毒的所有动物实验,将动物置于具有HEPA过滤器的负压分离器中,按照Zika病毒应急生物安全手册的要求在生物安全水平3(BSL-3)的动物设施中进行,并应根据病原微生物的危害等级穿戴相应的防护用品。 2)病毒接种:中国疾病预防控制中心病毒病预防控制出血热室馈赠的ZKC2/2016,提前解冻至室温,利用美国BD公司1ml胰岛素注射器(针头较细对动物的损伤较小)吸取25ul病毒液,注射上述24-36h的乳鼠脑中缝处。注意插针、注射及取针动作要轻柔以免对动物造成过大的损失。整个过程尽量让专人操作,操作人员受过专业培训并考核合格,保证每只乳鼠注射的位置、进针深度大致相同。 3)动物观察:攻毒后轻轻地将乳鼠放回原处,攻毒后乳鼠可能会出现尿失禁的现象。攻毒后的乳鼠体温会下降,注意保温。第2天观察乳鼠若出现死亡情况将乳鼠捡出,可能是死于机械损伤,冻存于-80℃冰箱以备统一高压灭菌或直接高压灭菌。 4)动物解剖:每天观察乳鼠情况,并于攻毒后第5天经处死乳鼠。利用解剖剪刀和镊子将鼠脑取出,放到提前在冰上提前预冷的2ml EP管中。 5)组织处理:将取出的感染Zika 病毒的鼠脑带至生物安全2级实验室进行下一步操作。传第一代病毒命名为ZKC2P1,第二代为ZKC2P2,以此类推。
3.3 适应株病毒鉴定 利用本研究设计的引物Zika 535和Zika 1211C,扩增Zika 病毒核酸获得包括引物探针的区域(835-911),PCR产物纯化后连接pGEM-T Easy载体,利用pGEM-T上的T7启动子,使目的片段535-1211可以在体外转录。
3.4 ZKC2P6对乳鼠致病力 选取24-36h乳鼠9窝,调整每窝乳鼠数量为6只,随机分为三组。ZKC2P6组、ZKC2P4及模拟感染组 (Mock) 分别脑内注射25ul含1.5×107 copies ZKCP6病毒液、25ul含1.5×107 copies ZKCP4病毒液及年龄匹配的空白鼠脑研磨上清液。攻毒后1dpi、3dpi、5dpi及7dpi称量每只乳鼠的体重并记录死亡情况。每组随机选取另外3窝乳鼠,攻毒后1dpi、3dpi、5dpi及7dpi每天取三只乳鼠脑并称量重量、测量长、宽。本研究利用Zika病毒感染初生乳鼠后观察小鼠大脑皮层及脑室的变化。将上述称量脑重的鼠脑固定后进行HE染色。ZKC2P4与ZKC2P6分别脑内感染一窝乳鼠(每窝6只),第3天和第5天分别取3只鼠脑并称重,按照病毒RNA提取操作流程提取RNA。 |
| 模型表型数据 | ZKC2/2016病毒传代过程中发现神经毒力增强的现象 从第5代开始,攻毒后第3天体重下降不是特别明显,但通过肉眼可观察到胃内奶量明显减少的现象。攻毒后第4天开始出现体重下降,症状进一步加重。攻毒后第5天小鼠出现较严重的症状,包括体重严重下降、呈严重病态、四肢痉挛僵直无力,走路转圈等。直到传至第八代均出现相同的现象。ZKC2/2016可能发生影响其神经毒性的突变。
图1 攻毒后第5天ZKC2P1与ZKC2P6感染乳鼠的形态比较 注:ZKC2P1表示ZKC2/2016第1次攻毒后第5天乳鼠的状态;ZKC2P6表示ZKC2/2016第6次攻毒后第5天乳鼠的状态。与ZKC2P1相比,ZKC2P6小鼠体形明显小、胃排空和呈疾病状态。
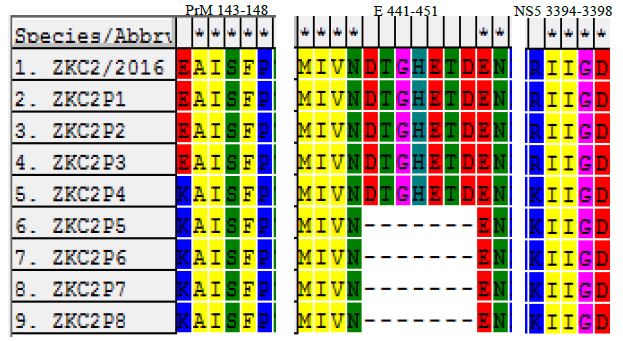
Zika病毒序列发生突变 利用DNAMAN和SeqMan进行序列拼接,利用MEGA进行序列比对发现ZKC2P4在PrM及NS5各存在一个点突变,分别是E143K和R3394K,ZKC2P5-ZKC2P8在ZKC2P4的基础上E蛋白糖基化位点区域缺失7个氨基酸(图1-3)。经过纯化的ZKC2P4与ZKC2P6病毒,进一步测定全基因组序列证实与未纯化前没有发生突变。全长序列通过在线软件Bankit(https://www.ncbi.nlm.nih.gov/WebSub/?tool=genbank)上传Genbank,获得Genbank号:MG674718和MG674719。
图2 Zika 病毒传代过程中的突变
适应株病毒鉴定及扩增保存 利用本研究设计的引物Zika 535和Zika 1211C,扩增Zika 病毒核酸获得包括引物探针的区域(835-911),PCR产物纯化后连接pGEM-T Easy载体,利用pGEM-T上的T7启动子,使目的片段535-1211可以在体外转录。 上述构建的质粒转化DH5α感受态细胞,挑取单菌落扩增。提取质粒送中美泰和公司测序,验证序列无误。M13F-47和M13R-48为引物相应质粒为模板进行PCR扩增。电泳鉴定,与目的片段(926bp)大小相符。
图3 标准品体外转录模板鉴定
已经纯化鉴定ZKC2P4与ZKC2P6经鼠脑扩大培养,各接种感染约50只乳鼠,去鼠脑组织于1ml DMEM中进行研磨。并利用荧光定量PCR测定病毒库的病毒浓度,设置3个复孔。经过计算ZKC2P6和ZKC2P4的浓度分别为8.3×109copies/ml和7.2×109copies/ml。将已测定Zika病毒RNA含量的病毒液冻存于-80℃冰箱备用。
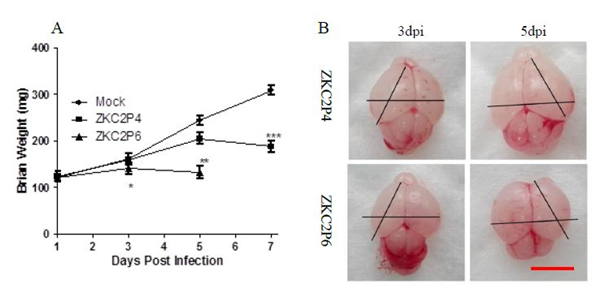
ZKC2P6对乳鼠致病力升高 攻毒前每只乳鼠称量并记录体重,并经过方差分析无统计学差异,说明54只乳鼠来自于同一个抽样总体。1dpi三组乳鼠体重没有统计学差异。攻毒后第3天,ZKC2P6乳鼠体重较攻毒后第1天体重有所增加,但是增长率小于ZKC2P4组及Mock组(P<0.001),通过两两比较ZKC2P4组及Mock组没有统计学差异。攻毒后第5天ZKC2P6小鼠较3dpi体重有所下降,ZKC2P4组小鼠较3dpi体重有所增加但是增长率小于Mock组,通过独立样本t检验ZKC2P4组与Mock组乳鼠体重具有统计学差异(P<0.05),三组方差分析比较乳鼠体重具有统计学差异(P<0.001)。攻毒后第7天ZKC2P6小鼠全部死亡,所以没无乳鼠体重记录,ZKC2P4小鼠较5dpi体重下降(图4 A)。 攻毒后每天观察小鼠,ZKC2P6组小鼠攻毒后第5天开始出现小鼠死亡,第7天全部死亡。ZKC2P4组小鼠攻毒后第8天开始出现小鼠死亡,第10天全部死亡(图4B)。ZKC2P6组小鼠攻毒后第3天小鼠体长体态没有明显变化,但肉眼可见乳鼠胃内奶含量较另外两组少;第5天体长明显小于ZKC2P4及Mock组,并呈现更重的病态,四肢僵直、胃排空、弓背、虚弱无法支撑其俯卧位(图4 C)。
图4 E蛋白糖基化位点缺失导致ZKC2P6神经毒力增强 注:A) ZKC2P6组、ZKC2P4组及模拟感染组 (Mock) 分别脑内注射25ul含1.5×107 copies ZKCP6病毒液、25ul含1.5×107 copies ZKCP4病毒液及年龄匹配的空白鼠脑研磨上清液,每组18只乳鼠。B) 生存分析: 每组18只乳鼠,Log-rank (mantel-cox) 进行生存分析。C)攻毒后第3天和第5天比较三组小鼠体长体态,从左到右依次是Mock、ZKC2P4和ZKC2P6组小鼠。*p<0.05.**p<0.01. ***p<0.001。通过方差分析或者t检验进行统计分析,数据用平均差±标准差形式表述。
ZKC2P6感染导致乳鼠鼠脑变小 每组随机选取另外3窝乳鼠,攻毒后1dpi、3dpi、5dpi及7dpi每天取三只乳鼠脑并称量重量。1dpi三组乳鼠脑重没有统计学差异。攻毒后第3天,ZKC2P6乳鼠脑重较攻毒后第1天脑重有所增加,但是增长率小于ZKC2P4组及Mock组(P<0.05),通过两两比较ZKC2P4组及Mock组没有统计学差异。攻毒后第5天ZKC2P6小鼠较3dpi脑重有所下降,ZKC2P4组小鼠较3dpi脑重有所增加但是增长率小于Mock组,通过独立样本t检验ZKC2P4组与Mock组乳鼠体重具有统计学差异(P<0.05)三组方差分析比较乳鼠体重具有统计学差异(P<0.01)。攻毒后第7天ZKC2P6小鼠全部死亡,所以没有称量乳鼠脑重,ZKC2P4小鼠较5dpi脑重下降(图5 A)。在3dpi和5dpi,测量ZKC2P4与ZKC2P6鼠脑脑宽和脑室宽,测量结果均显示:在攻毒后第3天和第5天ZKC2P6脑宽和脑室宽均小于ZKC2P4(图5 B)。
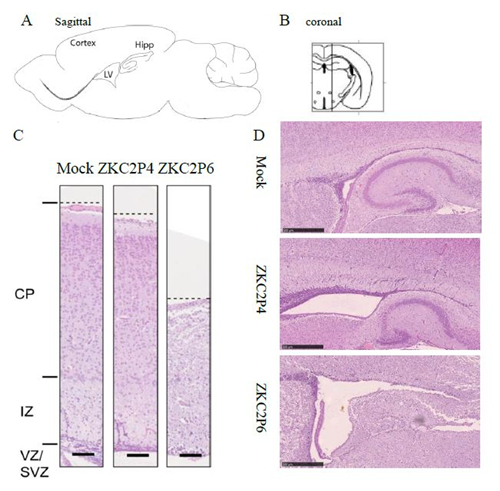
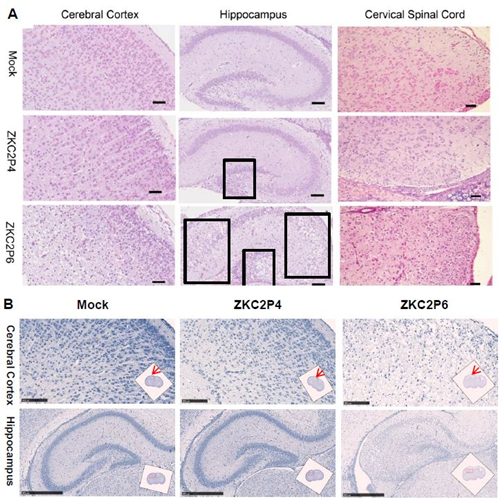
图5 ZKC2P6感染导致乳鼠鼠脑变小 注:A)比较每组鼠脑的重量。每组3只乳鼠。*p<0.05.**p<0.01. ***p<0.001。通过方差分析或者t检验进行统计分析,数据用平均差±标准差形式表述。B) 3dpi与5dpi,ZKC2P6鼠脑的脑宽及脑室宽均小于ZKC2P4组乳鼠。黑色线代表脑宽或者脑室宽,红色线为标尺0.5cm。 ZKC2P6感染导致乳鼠脑大皮层变薄和脑室扩大 本研究利用Zika 病毒感染初生乳鼠后观察小鼠大脑皮层及脑室的变化。将上述称量脑重的鼠脑固定后,HE染色,利用Nano Zoomer S60扫描3dpi和5dpi Mock、ZKC2P4和ZKC2P6的脑石蜡切片。3dpi 实验组相对于对照组脑部变化不明显。攻毒后第5天,ZKC2P4与ZKC2P6较对照组大脑皮层都有不同程度的变薄,ZKC2P6较ZKC2P4组大脑皮层变薄更明显(图 2-5 A);ZKC2P4与ZKC2P6较对照组脑室都有不同程度的扩大,ZKC2P6较ZKC2P4组脑室扩大更明显(图 2-5 B)。
图5 ZKC2P6感染导致乳鼠脑大皮层变薄和脑室扩大 注:A) 本部分实验索取切面为脑矢状面切片,红线表示测量大脑皮层厚度的位置。B)选用矢状面切片所处冠状面的位置。C) 攻毒后第5天比较乳鼠脑皮层厚度。HE染色。CP:皮层板,IZ:中间区域,VZ:脑室区,SVZ:亚脑室区。标尺表示100um。D) 攻毒后第5天比较乳鼠脑室大小。HE染色。标尺表示500um。
ZKC2P6感染引起乳鼠脑组织及脊髓病理损伤 ZKIV感染可引起胎儿小头症,脑及其他神经组织病理损伤。攻毒后第1、3 、5、7和10(除ZKC2P6组)天每组取3只鼠脑、颈髓及非神经器官肾组织(对照),固定后HE染色以便观察脑病变。各动物大脑注射部位神经元坏死,血管扩张充血,灶性出血。以下结果描述为大脑注射部位外病变情况。各组乳鼠1dpi、3dpi、5dpi、7dpi和1dpi0脑各部分、颈髓及肾脏病变程度评级(表2)。 攻毒后第1天,Mock组:脑组织未见明显病理改变。肾脏及脊髓未见病变。 ZKC2P4组:脑组织未见明显病变。肾脏及脊髓未见明显病变。ZKC2P6组:脑组织未见明显病理改变。肾脏及脊髓未见病变。 攻毒后第3天,Mock组:脑组织未见明显病理改变。肾脏及脊髓未见病变。 ZKC2P4组:3只(3/3)大脑皮层、海马、脑干、小脑可见少数神经元/胶质细胞坏死。大脑皮层未见明显病变。脊髓个别胶质细胞坏死。肾脏未见明显病变。ZKC2P6组:3只(3/3)大脑皮层、海马可见较多量神经元/胶质细胞坏死。脑干、小脑可见少数神经元/胶质细胞坏死。脊髓个别胶质细胞坏死。肾脏未见明显病变。 攻毒后第5天,Mock组:脑组织未见明显病理改变。肾脏及脊髓未见病变。 ZKC2P4组:大脑皮层可见较多神经元/胶质细胞坏死。海马、脑干、小脑可见少数神经元/胶质细胞坏死。脊髓少数胶质细胞坏死。肾脏未见明显病变。ZKC2P6组:大脑皮层水肿、血管扩张充血、大量神经元及胶质细胞坏死;海马大量神经元坏死;小脑较多量神经元坏死。脑干可见少数神经元及胶质坏死。脊髓少数神经元及胶质细胞坏死(图6A和B)。此外,对ZKC2P6组濒死小鼠骨骼肌及视网膜病理分析,未见明显病变。 攻毒后第7天,Mock组:脑组织未见明显病理改变。肾脏及脊髓未见病变。 ZKC2P4组:大脑皮层、小脑、海马可见大量神经元/胶质细胞坏死。大脑皮层水肿。脑干少数神经元及胶质细胞坏死。脊髓少数神经元/胶质细胞变性坏死。肾脏未见明显病变。此外,对ZKC2P4组濒死小鼠骨骼肌及视网膜病理分析,视网膜部分神经元变性坏死,骨骼肌未见明显病变。ZKC2 P6组:脑组织和脊髓自溶。尸检显示骨骼肌及视网膜未见明显病变。 攻毒后第10天,ZKC2P6组小鼠全部死亡,仅对Mock5组及ZKC2P4组进行病理分析。Mock组:脑组织未见明显病理改变。肾脏及脊髓未见病变。ZKC2P4组:大脑皮层、小脑、海马可见大量神经元/胶质细胞坏死。大脑局部病变严重,几乎完全坏死;海马CA3区及CA4区病变严重。脑干少数神经元及胶质细胞坏死。脊髓较多神经元及胶质细胞坏死。肾脏未见明显病变。尸检结果显示骨骼肌间质炎细胞浸润,视网膜部分神经元变性坏死。 表2 各组乳鼠脑、颈髓及肾病理评分 Table2 The lesion Degree of Various parts of the brain, cervical spinal cord and kidney disease
注:-,未见病变;±,轻微病变,偶见神经元/胶质细胞坏死;+,轻度病变,少数神经元/胶质细胞坏死;++,中度病变,较多神经元及胶质细胞坏死;+++,重度病变,大量神经元及胶质细胞坏死;++++,极重度病变,局部组织几乎完全坏死。+++++:自容。
图 6 攻毒后第5天乳鼠大脑皮层、海马及颈髓病理分析 注:ZKC2P6脑皮层弥漫性严重病变。海马黑框内区域病变明显。ZKC2P6颈髓病变程度强于ZKC2P4。A) HE染色,标尺为50um。B) Nissl染色,皮层标尺为100um,海马标尺为500um,选取图像位置用红箭头或者红框表示。
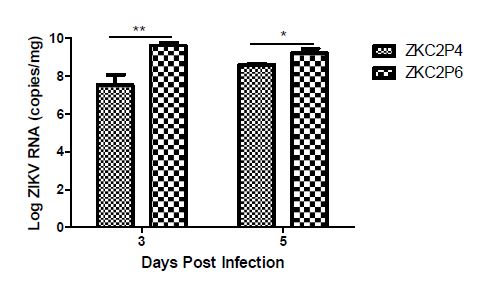
ZKC2P6在神经细胞内复制能力增强 ZKC2P4与ZKC2P6分别脑内感染一窝乳鼠(每窝6只),第3天和第5天分别取3只鼠脑并称重,按照病毒RNA提取操作流程提取RNA。荧光定量RT-PCR检测鼠脑内Zika 病毒RNA含量。通过计算获取每克(毫克)脑组织含有的病毒RNA拷贝。结果显示:攻毒后第3天和第5天ZKC2P6的RNA拷贝数均高于ZKC2P4,其中第3天每毫克脑组织含有ZKC2P6 RNA拷贝是ZKC2P4 RNA拷贝的125倍,第5天是4倍左右(图7)。
图7 E蛋白糖基化位点的缺失导致ZKC2P6在鼠脑内复制能力增强 注:ZKC2P6组、ZKC2P4及模拟感染组 (Mock) 1日龄乳鼠分别脑内注射25ul含1.5×107 copies ZKCP6病毒液、25ul含1.5×107 copies ZKCP4病毒液及年龄匹配的空白鼠脑研磨上清液。每组3只乳鼠。通过t检验进行统计分析,数据用平均差±标准差形式表述,*p<0.05,**p<0.01。 |
| 动物模型的评价与验证 | |
| 保存方式 | |
| 合作方式 | |
| 相关文章 | |
| 备注 | 需在生物安全实验室内构建,目前相关技术和SOP保存于中国医学科学院医学实验动物研究所感染性疾病研究平台,该平台可提供相应技术支持和服务 |






 京公网安备 11010502043083号
京公网安备 11010502043083号