| 标识符 | CSTR:16397.09.0C01001014 |
|---|---|
| 资源中文名称 | 手足口病柯萨奇病毒A10型腹腔感染小鼠模型 |
| 资源英文名称 | Coxsackievirus A10 infected mice model |
| 疾病概述 | 手足口病是由肠道病毒引起的传染病,多发生于5岁以下儿童,表现口痛、厌食、低热、手、足、口腔等部位出现小疱疹或小溃疡,多数患儿一周左右自愈,少数患儿可引起心肌炎、肺水肿、无菌性脑膜脑炎等并发症。个别重症患儿病情发展快,导致死亡。引发手足口病的肠道病毒有20多种(型),自2008年在新加坡的暴发流行,柯萨奇病毒A10型(Coxsackievirus A10,CA10)成为手足口病主要致病血清型之一,由其感染引起的手足口病爆发事件在法国、芬兰、印度等国家和地区不断被报道。2013年以前,中国多地区暴发流行的手足口病病原以EV71和CA16为主,CA6和CA10次之。2013年以后,CA10引起的手足口病比例逐渐上升,成为国内手足口病感染的优势病原体之一。CA10共分为A~G的7个基因型。目前国内外大多通过与周边地区或其他国家的流行株进行核苷酸和氨基酸的同源性对比,来分析CA10的流行情况。在我国,CA10近年来在多地区流行的病毒株保持着较高的同源性,与其他国家的分离株之间的同源性距离较远,具有地域分布特点以及一定的时间分布特点。CA10传染性强、隐性感染比例大、传播途径复杂、传播速度快,在短时间内可造成较大范围的流行,疫情控制难度大。 CA10病毒主要通过粪口途径传播,主要经胃肠道进入机体内。病毒在入侵的局部上皮细胞中完成增殖,然后病毒侵入局部淋巴组织中继续增殖并释放入血导致第一次病毒血症。病毒随血液传播接触到正常靶细胞。病毒表面的VP1蛋白与靶细胞表面特异性受体结合,完成吸附过程,其基因组RNA进入胞质。之后,病毒以其正链RNA作为模板,合成互补的负链RNA,又以负链RNA为模板合成病毒正链RNA,从而得到大量病毒RNA,进入子代病毒颗粒组装阶段。通过转录、翻译,复制出二代病毒,再次释放入血形成第二次病毒血症并引起临床症状。目前有大量研究表明,手足口病患儿的细胞免疫出现紊乱,并且这种免疫紊乱在重症与死亡病例中表现得更加严重。肺水肿被认为是感染的患儿中是最为严重的并发症之一,脑干的损伤则被认为是导致肺水肿的重要因素。很多研究表明参与细胞免疫的诸多炎性因子,例如IL-1、IL-6、IL-10、IL-13、IFN-γ、TNF-α的增加、T细胞亚群CD3+CD4+,以及自然杀伤细胞(NK)等,与肺水肿的发生具有相关性。 CA10易感染5岁以下年龄的幼儿,潜伏期多为2-10天。CA10感染儿童多引起轻型手足口病,患儿往往无明显的早期症状,大多数病人预后良好。临床上,往往表现为多发的斑丘疹和(或)疱疹,最多见于手足口、臂及膝关节。典型疱疹通常突出皮肤表面,呈现黄豆粒大小,圆形或椭圆形,其内液体混浊,常无疼痛和瘙痒感,约1周时间疱疹可自行消退,通常不留疤痕。病人或伴有发热、流涕、咳嗽、食欲不振、恶心、呕吐或腹泻等症状,一般能自愈,无后遗症。但少数儿童感染CA10后出现严重并发症,如脑膜炎、脑炎、急性弛缓性麻痹和神经呼吸综合征等。随着CA10流行程度的增加、重症病例的出现,开发针对性的抗病毒药物和疫苗成为当务之急,而建立稳定的CA10感染动物模型不仅是开发药物和疫苗的关键点之一,也为研究病毒的感染机制和机体免疫反应提供研究基础。 |
| 实验动物背景信息 | ICR小鼠毛色白化。适应性强,体格健壮,繁殖力强,生长速度快,实验重复性较好,雌鼠自发性畸胎瘤和管状腺瘤发病率为0%-1%,用氨基甲酸乙酯诱发时,11-16天胚胎期畸胎瘤和管状腺瘤发病率为5.9%,离乳个体管状腺瘤和囊瘤发生率为30%,孕鼠为3%。是国际通用的封闭群小鼠。外周血项和骨髓细胞,具有较好的稳定性,是良好的血液学实验用动物。是进行手足口病原研究的理想动物。 |
| 模型制作方法 | 1.病毒准备:CA10病毒(GenBank: MF688814.1),由医院咽拭子分离得到,在人横纹肌瘤细胞(RD)中培养、扩增,并采用反复冻融法释放病毒,离心富集病毒。具体操作如下:
RD细胞经常规传代培养接种到T75细胞培养瓶,感染前弃去原培养基,细胞用含2%双抗的PBS 洗2遍,吸出PBS后加入无血清DMEM培养基。接种适量的CA10病毒后,置37℃ 5% CO2培养箱孵育1-2h;加入完全培养基继续培养。接种病毒后2-3d病变CPE达到+++~++++,将T75细胞瓶置封口袋中,-80℃超低温冰箱冻化3次。然后将培养液转移至50mL离心管中,4℃,2000rpm离心20min,沉淀细胞碎片。吸取病毒上清,分装后冻存,并测定病毒滴度TICD50。 2.实验动物:采用SPF级7日龄ICR小鼠乳鼠,母鼠自然哺乳,在ABSL-2实验室独立饲养。CA10动物模型建立实验通过IACUC审核,符合动物实验要求。
3.病毒感染:根据预实验确定的感染剂量,即104 TCID50 CA10病毒,将病毒经腹腔注射感染小鼠,注射剂量为100μl。对照组注射同等量的RD细胞上清。
|
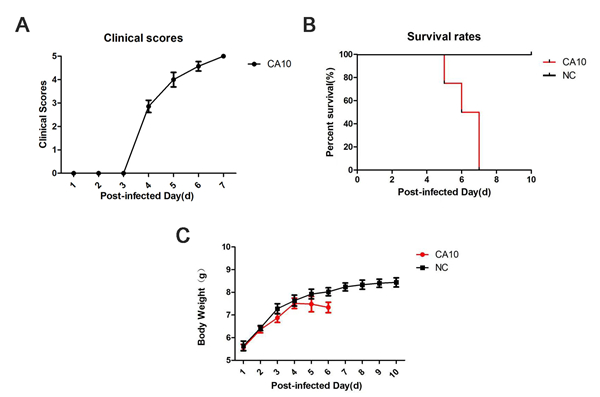
| 模型表型数据 | 1. 动物症状观察: 7日龄ICR小鼠感染CA10病毒4天后,出现不同程度的临床症状,症状由轻到重包括:驼背或炸毛,后肢无力,单后肢瘫痪,双后肢瘫痪,严重的直至死亡。感染后第5天,感染小鼠临床症状评分超过4分(图1A);感染后第7天,感染小鼠全部死亡(图1B)。相对于正常组小鼠,感染小鼠体重增加减缓,从感染第1天的5.57g增加到第6天的7.33g,而正常小鼠从5.64g增加到8.03g(图1C)。
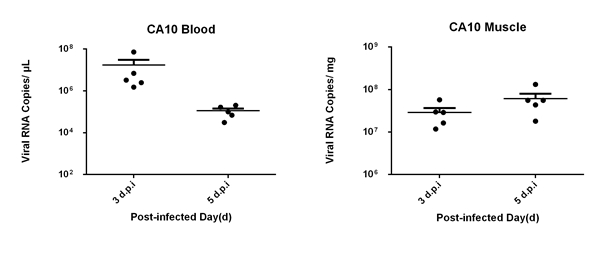
图1. ICR 7日龄乳鼠感染CA10病毒后症状观察。A,感染后乳鼠的临床症状评分时间变化曲线;B,感染后乳鼠的存活率时间变化曲线;C,感染后乳鼠体重随时间变化曲线。 2. 血液和组织中病毒复制情况: 感染后第1天血液和肌肉组织中病毒载量都低于检测阈值。到第3天血液中病毒载量到达高水平1.7X107 copies/μl,随后血液中病毒载量下降至1.1X105copies/μl。后肢肌肉的病毒载量在感染后第3天和第5天都维持很高的水平,分别为2.9X107 copies/mg和6.1X107 copies/mg。
图2. ICR 7日龄乳鼠感染CA10病毒后血液和组织中病毒载量情况。A,感染后第3天和第5天血液中病毒载量情况; B,感染后第3天和第5天后肢肌肉组织中病毒载量情况。 |
| 动物模型的评价与验证 | 1. 临床症状观察: 动物感染CA10病毒后观察10天,每天记录体重变化、症状和死亡率。根据症状严重程度,参照以下标准低动物进行临床评分打分: 0:未见异常; 1:驼背或炸毛; 2:后肢迟缓无力; 3:单后肢瘫痪; 4:双后肢瘫痪; 5:死亡。 2. CA10病毒载量测定方法:实时荧光定量PCR技术-标准曲线法。 2.1取样:分别在感染后第1天、第3天、第5天处死动物,采集血液100ul和后肢肌肉组织样本50mg,放入Trizol中; 2.2 RNA提取:采用Trizol法提取血液和肌肉组织中的RNA; |
| 保存方式 | 活体繁殖 |
| 合作方式 | |
| 相关文章 | |
| 备注 |


 京公网安备 11010502043083号
京公网安备 11010502043083号