| 标识符 | CSTR:16397.09.0G16000448 |
|---|---|
| 资源中文名称 | 基于HIV融合抑制剂的艾滋病潜伏感染恒河猴模型 |
| 资源英文名称 | Latent Infected Animal Model for AIDS with HIV Fusion Inhibitor |
| 疾病概述 | 艾滋病(Acquired Immunodeficiency Syndrome, AIDS),是由人免疫缺陷病毒(Human Immunodeficiency Virus, HIV)引起,以全身免疫系统严重损害为特征的传染性疾病,是20世纪危害人类健康和生命最严重的病毒性疾病之一。自美国CDC报道首例艾滋病后,到20世纪80年代中期艾滋病发展成为一个全球性的流行病。截止2014年底,HIV已感染3690万人,2014年新增感染者200万,2014年因艾滋病死亡120万人。艾滋病在1985年传入我国,截至2015年5月31日,全国历年累计报告艾滋病530628例,其中艾滋病病人217457例,死亡167159例。艾滋病早已成为全球关注的公共卫生和社会热点问题,艾滋病的预防与治疗也成为当代生物医学研究的前沿热点之一。 |
| 实验动物背景信息 | 选用体重4-6 kg的SPF恒河猴。实验前体检无异常,必须排除猴免疫缺陷病毒(SIV)、猴逆转录D型病毒(SRV-1,2,5)和猴T淋巴细胞性I型病毒(STLV-1)的感染。猴免疫缺陷病毒(SIV)易感性密切相关的4种基因(Mamu-A*01、Mamu-A*02、Mamu-B*08、Mamu-B*17)筛查结果为阴性。所有感染动物必须在ABSL-3室中进行。 |
| 模型制作方法 | 1、实验材料:SHIVSF162P3病毒;选用体重4-6 kg的SPF恒河猴。实验前体检无异常,必须排除猴免疫缺陷病毒(SIV)、猴逆转录D型病毒(SRV-1,2,5)和猴T淋巴细胞性I型病毒(STLV-1)的感染。猴免疫缺陷病毒(SIV)易感性密切相关的4种基因(Mamu-A*01、Mamu-A*02、Mamu-B*08、Mamu-B*17)筛查结果为阴性。所有感染动物必须在ABSL-3室中进行。 2、静脉途径SHIV恒河猴感染模型制作方法:
先用宠物用电推剪推去猴上肢采血部位的猴毛,左手抓住一侧后肢跗关节部位,使后肢皮下静脉怒张。用75%酒精酒精棉球消毒。右手拿吸取病毒液的注射器,针头沿静脉平行方向向向心端刺入血管,见回血后,左手放松,不再紧压,右手缓慢将病毒液推入。完毕后用干棉球压迫止血,将注射器拔出,弃在利器专用桶内。 3、给药方法:将建立稳定的SHIVSF162P3慢性感染的恒河猴,经肌肉注射3mg/kg的HIV融合抑制剂,每周给药一次,连续给药6个月。
样本收集和检测:定期收集外周血样本,提取病毒RNA和病毒DNA,测定血浆病毒载量和总病毒DNA。 |
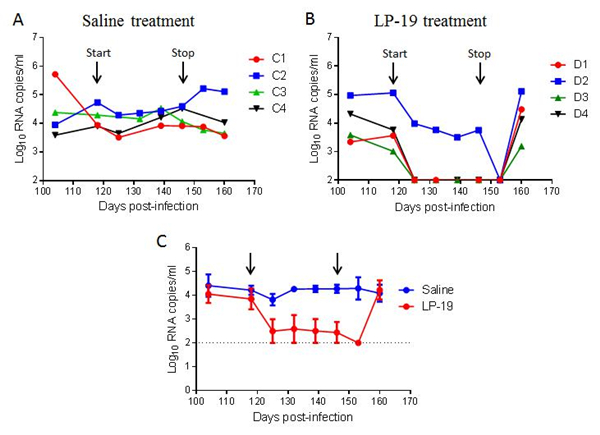
| 模型表型数据 | 1、血浆病毒载量变化情况:
图1 LP-19在恒河猴SHIV感染模型的治疗效果
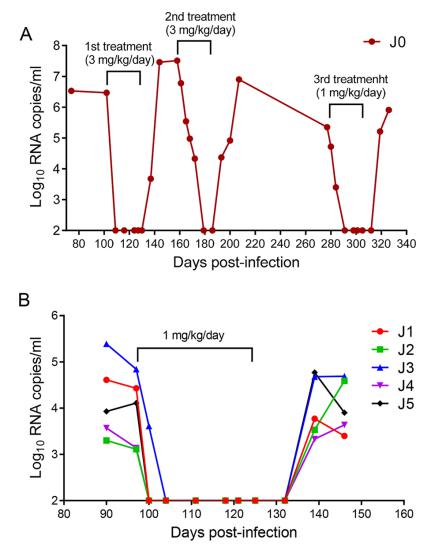
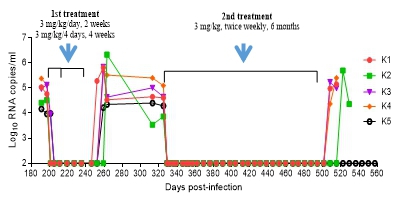
图2 LP-51在恒河猴SHIV感染模型的治疗效果 我们通过对LP-51进行结构优化获得LP-80,其在细胞水平上的抑制活性高于T-20和广谱中和抗体VRC01大于5300倍,在猴体内的活性高于T-20超过10000倍。在大鼠和恒河猴的药代动力学研究表明,LP-80在体内可以达到极高的药效浓度,且半衰期较长,适于每周1-2次给药治疗。如图3所示,LP-80对SHIV慢性感染猴子反复两次的治疗都表现出很好的治疗效果[3]。第一次治疗时,猴子采取每天给药联合每4天给药的方式,发现一周两次治疗可以很好地控制猴子的血浆病毒载量至检测线以下。待停药后病毒反弹稳定,我们继续给予一周两次、持续6个月的第二次治疗。
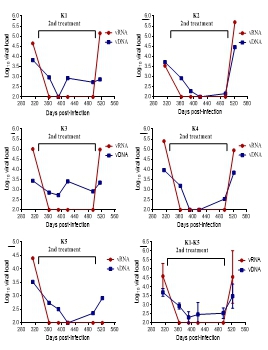
图3 LP-80在恒河猴SHIV感染模型的病毒RNA结果 2、病毒DNA变化情况:
图4 LP-80在恒河猴SHIV感染模型的病毒DNA结果 3、血生化检测
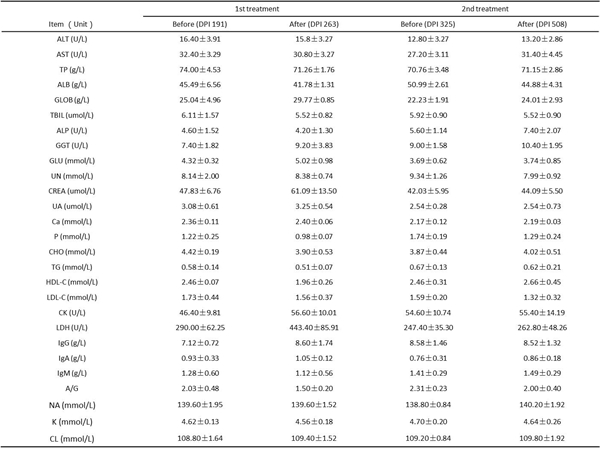
动物模型建立的整个实验过程中,全部实验猴分别在第一次治疗和第二次治疗前后检测血生化,未见明显差异。而且,在动物安乐后,各组织脏器未见明显异常。
|
| 动物模型的评价与验证 | 1、血浆病毒载量测定:提取EDTA抗凝血浆中病毒RNA,使用SYBR Green I 实时荧光定量RT-PCR方法测定血浆病毒载量。 2、病毒DNA测定:提取PBMC中病毒DNA,使用SYBR Green I 实时荧光定量RT-PCR方法测定血浆病毒载量。 3、CD4+T细胞绝对数和CD4+/CD8+比值测定:CD3-PerCP、CD4-FITC、CD8-PE抗体标记EDTA抗凝全血淋巴细胞,流式细胞仪测定CD4+/CD8+比值,并根据血常规结果,计算出CD4+T细胞绝对数。 |
| 保存方式 | |
| 合作方式 | |
| 相关文章 |
[1]Chong H(#), Xue J(#), Xiong S, Cong Z, Ding X, Zhu Y, Liu Z, Chen T, Feng Y, He L, Guo Y, Wei Q, Zhou Y, Qin C*, He Y*. A Lipopeptide HIV-1/2 Fusion Inhibitor with Highly Potent In Vitro, Ex Vivo, and In Vivo Antiviral Activity. J Virol. 2017 May 12;91(11):e00288-17. [2]Chong H(#), Xue J(#), Zhu Y, Cong Z, Chen T, Guo Y, Wei Q, Zhou Y, Qin C*, He Y*. Design of Novel HIV-1/2 Fusion Inhibitors with High Therapeutic Efficacy in Rhesus Monkey Models. J Virol. 2018 Jul 31;92(16):e00775-18. [3]Chong H(#), Xue J(#), Zhu Y, Cong Z, Chen T, Wei Q, Qin C*, He Y*. Monotherapy with a low-dose lipopeptide HIV fusion inhibitor maintains long-term viral suppression in rhesus macaques. PLoS Pathog. 2019 Feb 4;15(2):e1007552. |
| 备注 |


 京公网安备 11010502043083号
京公网安备 11010502043083号