| 标识符 | CSTR:16397.09.0I01001032 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 资源中文名称 | Isca1心肌特异性基因敲除SD大鼠 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 资源英文名称 | Isca1(tm-loxP)/α-MHC-Cre | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 疾病概述 | 心力衰竭,简称心衰,是指由于心脏收缩和(或)舒张功能障碍,无法将静脉回心血量充分排出心脏,导致静脉系统血液淤积,动脉系统灌注不足,从而引发心脏循环障碍症候群,心衰并不是一个独立的疾病,而是所有心血管疾病发展的终末阶段。 近年来,随着我国社会老龄化和高血压,冠心病等心血管疾病发病率的增加,使得心衰呈现高发病率,高致残率和高死亡率的特点,《2018中国心力衰竭诊断和治疗指南》中报道我国心衰患病率为0.9%,有1000万左右的心衰患者。 几乎所有的心血管疾病最终都会导致心衰的发生,而在基础性心脏病的基础上,一些因素亦可诱发心衰的发生,常见诱因包括,感染,严重心律失常,心脏负荷增大,药物中毒(如洋地黄)等等。 心衰在临床上可分为急性心衰和慢性心衰。临床表现,包括呼吸困难,运动耐力下降,心室腔增大,心脏功能下降(LVEF<40-50%),心脏顺应性降低,心室腔内淤血,肺循环及体循环淤血。 临床检查手段,包括超声影像分析,心电图,心衰标志物(B型利钠肽(BNP),N末端B型利钠肽原(NT-proBNP))心肌坏死标志物(心肌肌钙蛋白T(cTnT)及心肌肌钙蛋白I(cTnI))。 临床治疗方法,包括强心(米力农,地高辛),利尿(速尿),抗感染,改善心肌重构(卡维地洛)及心脏移植。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 实验动物背景信息 | SD大鼠 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 模型制作方法 | 3.1 实验材料 3.1.1 实验动物 SD大鼠购自北京维通利华实验动物技术有限公司【SCXK(京)2012-001】。实验中涉及动物的操作程序已获得中国医学科学院医学实验动物研究所实验动物使用与管理委员会的批准,批准号为ZLF18003. 3.1.2实验仪器
3.1.3实验试剂
3.1.4模型构建流程 利用Cre/loxP重组系统的原理,进行条件性敲除(Conditional knockout,CKO),制备心肌组织特异性Isca1敲除大鼠。在Isca1基因第三外显子两端插入两个loxP位点来构建Isca1flox/+大鼠,使其与αMHC-Cre大鼠进行杂交,经两轮杂交最终获得Isca1flox/flox/MHC-Cre大鼠,并使用PCR方法进行基因型鉴定,使用Western blot技术进行敲除效率的鉴定。 3.1.5 Isca1条件性敲除大鼠及心肌组织特异性Isca1敲除大鼠的建立 3.1.5.1 Isca1条件性敲除大鼠模型的建立
图 1. Isca1条件性敲除模型构建设计方案
靶点1: GCCTCCTGAGCAAGTGCT GGG R-ISCA1-gRNA UP1 5’TAGGGCCTCCTGAGCAAGTGCT R-ISCA1-gRNA DOWN1 5’AAACAGCACTTGCTCAGGAGGC 靶点2: AGCCCTGAACTCCTTATG TGG R-ISCA1-gRNA UP2 5’TAGGAGCCCTGAACTCCTTATG R-ISCA1-gRNA DOWN2 5’AAACCATAAGGAGTTCAGGGCT
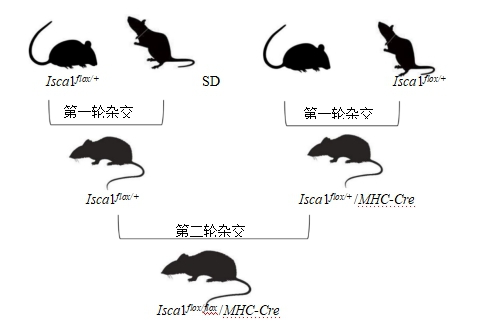
3.1.5.2 心肌组织特异性Isca1敲除大鼠(Isca1flox/flox/MHC-Cre)的建立 根据3.1.5.1获得Isca1flox/+大鼠F1代后,首先通过8周龄左右Isca1flox/+与野生型大鼠进行杂交,获得一定数量的Isca1flox/+大鼠。与此同时使8周龄左右Isca1flox/+大鼠与αMHC-Cre大鼠(SD. Tg(MHC-CRE)-GC/ILAS,http://www.ratresource.com)进行杂交,得到Isca1flox/+/MHC-Cre大鼠。之后使8周龄左右Isca1flox/+大鼠与Isca1flox/+/MHC-Cre大鼠进行第二轮杂交,可得到Isca1flox/flox/MHC-Cre大鼠,即心肌组织特异性Isca1敲除纯合子大鼠,用于后续实验。
图 2. Isca1flox/flox/MHC-Cre大鼠的繁育
3.1.5.3 鼠尾基因组DNA提取 在幼崽出生后剪脚趾标记,收集幼崽脚趾至1.5 mL EP管。然后参照DNA提取试剂盒说明书按以下程序操作。
将离心柱置于一干净的离心管中,开盖静置5 min,在柱的中央加入50~200 μL预热EB(60℃~70℃),盖上盖子,室温静置3 min,12000 rpm 离心2 min,洗脱DNA。保存至4℃冰箱。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 模型表型数据 | 4.1 心肌组织特异性Isca1敲除大鼠模型的建立 利用Cre/loxP重组系统的原理,进行条件性敲除(Conditional knockout,CKO),制备心肌组织特异性Isca1敲除大鼠。在Isca1基因第三外显子两端插入两个loxP位点来构建Isca1flox/+大鼠,使其与αMHC-Cre大鼠进行杂交,经两轮杂交最终获得Isca1flox/flox/MHC-Cre大鼠,通过PCR方法进行基因型鉴定心肌组织特异性Isca1敲除大鼠基因型。免疫印迹Western blot方法鉴定Isca1flox/flox/MHC-Cre大鼠ISCA1蛋白的敲除效率达90%以上(图3)。
4.2 心肌组织特异性Isca1敲除大鼠生存率分析 为观察心肌组织特异性Isca1敲除大鼠子代基因型及生存率情况,将 Isca1flox/+大鼠与MHC-Cre大鼠经两代杂交,得到野生型(WT)、心肌特异性Isca1敲除大鼠杂合子(Isca1flox/+/MHC-Cre)和心肌特异性Isca1敲除大鼠纯合子(Isca1flox/flox/MHC-Cre)幼崽,根据孟德尔定律,上述基因型比例应为5:2:1,实验结果显示,累积统计幼崽共127只,其中WT幼崽74只,Isca1flox/+/MHC-Cre 幼崽37只,Isca1flox/flox/MHC-Cre幼崽16只,经计算可得子代中野生型、杂合子型、纯合子型三种基因型幼崽出生比例基本符合孟德尔定律(图4)。对三种基因型子代进行生存率分析显示,子代中WT和Isca1flox/+/MHC-Cre幼崽生存正常,生存率为100%,Isca1flox/flox/MHC-Cre幼崽7~10天全部死亡,至11天生存率为0%(图4)。
图4 心肌组织特异性Isca1敲除大鼠生存率分析 注:(A)Isca1flox/+大鼠与Isca1flox/+/MHC-Cre大鼠杂交后,出生子代基因型情况统计。(B)Isca1flox/+大鼠与Isca1flox/+/MHC-Cre大鼠杂交后,WT和Isca1flox/flox/MHC-Cre子代生存率统计。
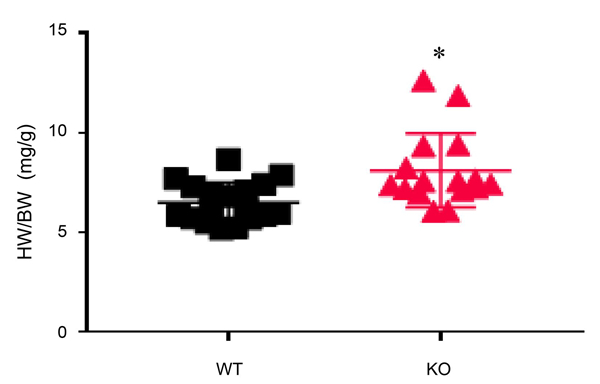
4.3 心肌组织特异性Isca1敲除大鼠心脏重量/体重比分析 使 Isca1flox/+大鼠与Isca1flox/+/MHC-Cre大鼠杂交,于子代出生后6.5天对WT和Isca1flox/flox/MHC-Cre(CKO)子代进行大体形态观察并计算心脏重量与体重之比(heart weight/body weight,HW/BW)。实验结果,与野生型相比,6.5 d CKO大鼠呼吸虚弱,处于濒临死亡状态(图5),并且心脏外观出现明显肥大。6.5 d CKO大鼠HW/BW平均值±标准差为(8.11 ± 1.85)mg/g,较6.5 d WT大鼠(平均值±标准差为(6.50 ± 1.01) mg/g)显著增加,有显著性差异(图5,*P<0.05)。
图 5 心肌组织特异性Isca1敲除大鼠HW/BW比率分析
4.4 M型超声心动图检测6.5 d心肌特异性Isca1敲除大鼠心脏的结构和功能 为分析心脏结构与功能状态改变,本研究通过M型超声心动图检测6.5 d 野生和心肌组织特异性敲除大鼠心脏的结构和功能。发现与同窝WT大鼠相比,6.5 d KO大鼠射血分数大幅下降,左心室内径明显增大,伴随室壁变薄,表现为收缩无力,心室严重扩张,已出现心功能下降、严重心衰的症状。
表1. 6.5 d心肌组织特异性Isca1敲除大鼠心脏M型超声影像参数分析
注:左心室舒张末期内径(left ventricular end-diastolic diameter,LVID;d);左心室收缩末期内径(left ventricular end-systolic diameter,LVID;s);射血分数(ejection fraction,EF);短轴缩短率(fractional shortening,FS);舒张期左心室后壁厚度(left ventricular posterior wall; diastolic,LVPW;d);收缩期左心室后壁厚度(left ventricular posterior wall; systolic,LVPW;s);舒张期左心室前壁厚度(left ventricular anterior wall; diastolic,LVAW;d);收缩期左心室前壁厚度(left ventricular anterior wall; systolic,LVAW;s)。*P<0.05,**P<0.01,versus同窝WT大鼠。
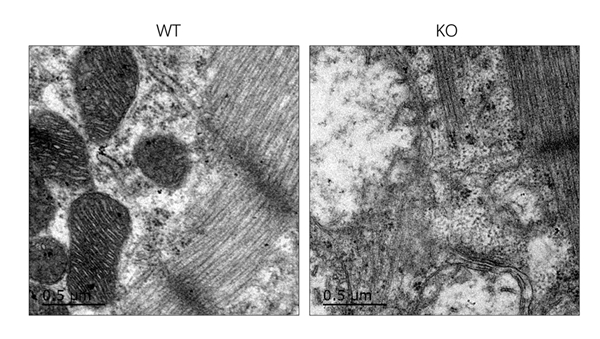
4.5 心肌组织特异性Isca1敲除大鼠心肌纤维及线粒体形态观察 为进一步分析心肌组织特异性Isca1敲除大鼠心肌纤维和线粒体形态改变,取6.5 天WT和心肌组织特异性Isca1敲除大鼠,摘取心脏,取左心室2 mm×2 mm大小新鲜组织,使用电镜专用固定液进行固定,制备电镜样本并进行观察。结果显示,WT大鼠心肌纤维排列整齐,肌节和Z线清晰,心肌内线粒体多呈圆形或椭圆形,线粒体双层膜膜结构清晰,嵴致密。而6.5 天心肌组织特异性Isca1大鼠敲除心肌纤维出现断裂,肌节和Z线严重模糊,部分位置纤维已溶解,心肌内线粒体膜结构受损,线粒体内嵴结构消失,线粒体肿胀及空化严重(图6)。
图6心肌组织特异性Isca1敲除大鼠超微结构形态观察 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 动物模型的评价与验证 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 保存方式 | 活体繁殖 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 合作方式 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 相关文章 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 备注 |





 京公网安备 11010502043083号
京公网安备 11010502043083号