| 标识符 | CSTR:16397.09.0I01001030 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 资源中文名称 | Epha4敲除大鼠 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 资源英文名称 | SD.Epha4(tm-mCherry)-GC/ILAS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 疾病概述 | 心律失常(arrhythmia)是由于窦房结激动异常或激动产生于窦房结以外,激动的传导缓慢、阻滞或经异常通道传导,即心脏活动的起源和(或)传导障碍导致心脏搏动的频率和(或)节律异常。心律失常是心血管疾病中重要的一组疾病。它可单独发病,亦可与其他心血管病伴发。其预后与心律失常的病因、诱因、演变趋势、是否导致严重血流动力障碍有关,可突然发作而致猝死,亦可持续累及心脏而致其衰竭。 遗传性心律失常多为基因通道突变所致,如长QT综合征、短QT综合征、Brugada综合征等。后天获得性心律失常可见于各种器质性心脏病,其中以冠状动脉粥样硬化性心脏病、心肌病、心肌炎和风湿性心脏病多见,尤其在发生心力衰竭或急性心肌梗死时。另有发生在基本健康者或植物神经功能失调患者中的心律失常。其他病因包括电解质或内分泌失调,麻醉,低温,胸腔或心脏手术,药物作用和中枢神经系统疾病等,部分病因不明。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 实验动物背景信息 | SD大鼠 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 模型制作方法 | 包括实验材料(实验动物、试剂、仪器)、实验环境、细胞培养/载体构建//蛋白表达/病原培养鉴定方法、实验操作规程、动物处理伦理等内容。 3.1 实验材料 3.1.1 实验动物 SD大鼠购自北京维通利华实验动物技术有限公司【SCXK(京)2012-001】。实验中涉及动物的操作程序已获得中国医学科学院医学实验动物研究所实验动物使用与管理委员会的批准,批准号为ZLF18003. 3.1.2实验仪器
3.1.3实验试剂
3.1.4模型构建流程 在Epha4基因的启动子后插入一个报告基因mCherry,造成移码突变,实现基因敲除,制备Epha4基因敲除大鼠,并使用PCR方法进行基因型鉴定,使用Western blot技术进行敲除效率的鉴定。 3.1.5 Epha4敲除大鼠的建立 3.1.5.1 Epha4敲除大鼠模型的建立
图 1. Epha4敲除模型构建设计方案
靶点1: CCA GCCTCCGGAGACCTTGAG R-EPHA4-gRNA UP1 5’TAGGCTCAAGGTCTCCGGAGGC R-EPHA4-gRNA DOWN1 5’AAACGCCTCCGGAGACCTTGAG 靶点2: CCC GGCGAATGAAGGTAAGAG R-EPHA4-gRNA UP2 5’TAGGCTCTTACCTTCATTCGCC R-EPHA4-gRNA DOWN2 5’AAACGGCGAATGAAGGTAAGAG
3.1.5.2 Epha4敲除大鼠的建立 根据3.1.5.1获得Epha4-/-大鼠F1代后,首先通过8周龄左右Epha4-/-与野生型大鼠进行杂交,获得一定数量的Epha4+/-大鼠。之后使8周龄左右Epha4+/-大鼠进行第二轮杂交,可得到Epha4-/-大鼠,用于后续实验。
3.1.5.3 鼠尾基因组DNA提取 在幼崽出生后剪脚趾标记,收集幼崽脚趾至1.5 mL EP管。然后参照DNA提取试剂盒说明书按以下程序操作。
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 模型表型数据 | 4.1 Epha4敲除大鼠模型的建立 通过PCR方法进行基因型鉴定Epha4敲除大鼠基因型。免疫印迹Western blot方法鉴定Epha4-/-大鼠epha4蛋白的敲除(图2)。
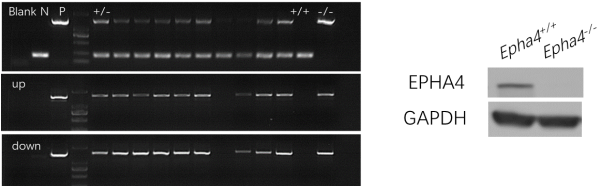 图2 Epha4敲除大鼠模型基因型鉴定及基因蛋白表达水平鉴定
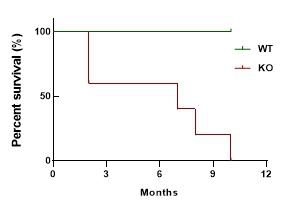
4.2 Epha4敲除大鼠生存率分析 对Epha4-/-基因型和WT野生型进行生存率分析显示,WT生存正常,生存率为100%,Epha4-/-生存率下降(图3)。
图3 Epha4敲除大鼠生存率分析
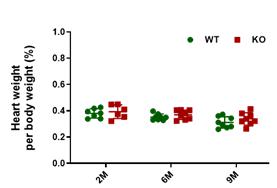
4.3 Epha4敲除大鼠心脏重量/体重比分析
图 5 Epha4敲除大鼠AW/HW比率分析 4.4 M型超声心动图检测Epha4敲除大鼠心脏的结构和功能 为分析心脏结构与功能状态改变,本研究通过M型超声心动图检测1、2、6、9四个月龄野生和敲除大鼠心脏的结构和功能。发现与同窝WT大鼠相比,自2M起,Epha4-/-大鼠射血分数明显下降,差异显著(图6,*P<0.05,**P<0.01),而左心室内径、室壁均无明显变化(图6)。
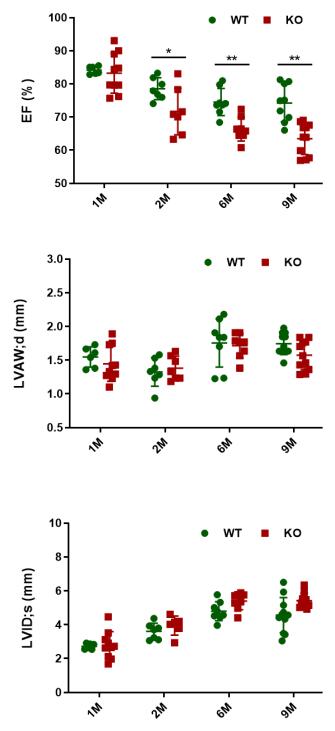 图 6 Epha4敲除大鼠左心室结构功能分析 注:射血分数(ejection fraction,EF);舒张期左心室前壁厚度(left ventricular anterior wall; diastolic,LVAW;d);左心室舒张末期内径(left ventricular end-diastolic diameter,LVID;d);、。*P<0.05,**P<0.01,versus同窝WT大鼠。
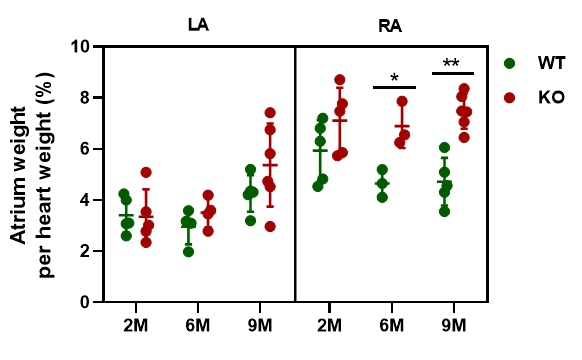
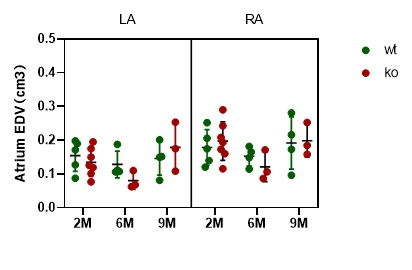
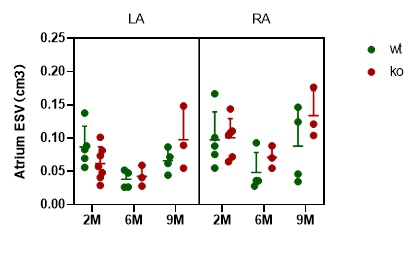
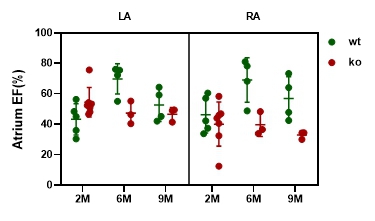
4.5磁共振成像分析Epha4敲除大鼠心房结构和功能 为进一步分析Epha4敲除大鼠心房的结构和功能,本研究通过核磁分析2、6、9月龄WT和Epha4敲除大鼠左右心房容积和射血分数。结果表明,与WT大鼠相比,Epha4敲除大鼠左右心房容积均无明显变化。但6、9月龄敲除大鼠心房射血分数与野生大鼠相比明显下降,6M组 WT左房射血分数为69.763±9.918(%),KO左房射血分数为47.35±7.458(%);WT右房射血分数为69.123±14.592(%),KO右房射血分数为39.67±7.653(%)。9M组WT左房射血分数为52.738±10.739(%),KO左房射血分数为46.637±4.487(%);WT右房射血分数为56.978±14.281(%),KO右房射血分数为32.967±2.492(%)(图7)。
图 7 Epha4敲除大鼠左右心房结构功能分析
4.6心电分析Epha4敲除大鼠心传导功能 从上面的结果我们已知,心房的改变发生在心室改变之前,为了进一步分析心房的电传导功能,我们对WT和Epha4敲除大鼠进行了心电图记录。结果显示,自1M起,敲除大鼠的心电出现了明显的改变,p波消失(图8),QRS波峰值增高,QT间期延长(图9,**P<0.01)。
图 8 Epha4敲除大鼠心电图记录
图 9 Epha4敲除大鼠心电指标分析 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 动物模型的评价与验证 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 保存方式 | 活体繁殖 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 合作方式 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 相关文章 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 备注 |





 京公网安备 11010502043083号
京公网安备 11010502043083号