| 标识符 | CSTR:16397.09.0G01001031 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 资源中文名称 | MBP敲除大鼠(MBP-Cre大鼠) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 资源英文名称 | MBP gene knockout rat_(MBP-Cre knockin rat) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 疾病概述 | 脱髓鞘疾病,是一类由遗传性遗传因素、病毒感染或自身免疫等因素造成神经纤维的髓鞘脱失造成的疾病,髓鞘的脱失会使神经冲动的传送受到影响,会导致肢体颤抖、运动共济失调、多发性硬化以及癫痫。病变部位主要在脊髓、小脑、脑干。 这类疾病主要表现为肢体无力、平感觉异常、进行性肢体协调运动障碍、眼部症状等,并可伴有复杂的神经系统损害,亦可伴大脑皮质功能损害如认知功能障碍和(或)精神行为异常等。病理特征主要表现为神经纤维髓鞘破坏,病灶呈多发性播散,分布于中枢神经的白质,沿小静脉周围炎症细胞浸润。神经细胞/轴突以及支持组织相对完成。该类疾病的发病高峰为二到三周,若治疗延误受损神经继发缺血变性则发生多发性硬化,发病严重时可侵犯脊髓前角细胞和脑干神经核以及大脑运动皮质锥体细胞危及生命。 该疾病的发病率较高,倾向于年轻人患病,中国预测枚10万人约有2人发病,我国人口基数较大,因此该类疾病仍是一个非常严峻的问题。发病机制总结如下图所示。 诊断方法包括(1)脑脊液(CSF)检查,IgG鞘内合成检测;(2)诱发电位检测,脱髓鞘病变使得神经传导速度减慢,潜伏期延长、拨付降低;(3)MRI检查。 药物治疗,主要是通过抑制炎性脱髓鞘病变进展,防止疾病其病变恶化,晚期对症支持疗法,减轻神经功能障碍带来的痛苦。治疗药物主要包括(1)皮质类固醇,如甲基泼尼松龙、泼尼松、IFN-β1a& IFN-β1b重组制剂、硫唑嘌呤、醋酸格拉太米尔等。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 实验动物背景信息 | 实验所用大鼠为SD(Sprague Dawley)背景。1925年由美国Sprague dawley农场用Wistar培育而成。特点是头部狭长,尾长接近身长,产仔多,生长发育比wistar快,抗病能力尤其对呼吸系统抵抗力强,自发肿瘤率低,对激素感受性高。该品系在国内使用频率高,价格相对便宜。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 模型制作方法 | 3.1 实验材料 3.1.1 实验动物 SD大鼠购自北京维通利华实验动物技术有限公司【SCXK(京)2012-001】。超排用雌鼠数量10-15只,年龄3周龄,交配传代用野生型SD大鼠为成年8-10周龄大鼠。实验中基因工程大鼠由本实验室繁殖产生。实验中涉及动物的操作程序已获得中国医学科学院医学实验动物研究所实验动物使用与管理委员会的批准,批准号为ZLF18003.
3.1.2实验仪器
3.1.3实验试剂
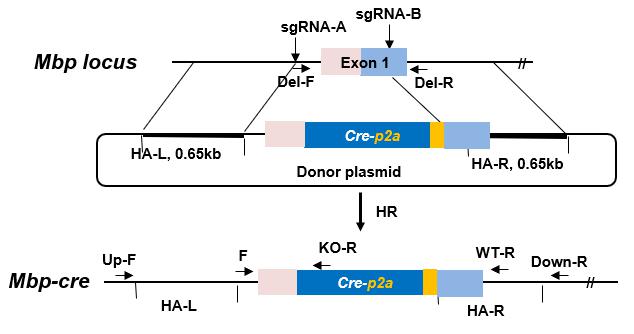
3.1.4模型构建流程 利用CRISPR/Cas9技术制备MBP敲除大鼠。在MBP基因起始密码子之前插入Cre重组酶,来构建MBP-Cre大鼠(SD.MBP(tm-Cre)-GC/ILAS)。该模型与Cre 报告大鼠进行杂交(SD.Rosa26(tm-imCherry)-GC/ILAS),可以检测MBP基因的表达图谱,同时通过杂合子交配的方式可以获得该基因敲除的纯合子大鼠,使用PCR方法进行基因型鉴定,使用Western blot技术进行蛋白水平敲除效率的鉴定。 3.1.5 MBP-Cre大鼠的建立 3.1.5.1 MBP-Cre大鼠模型的建立
图 1. MBP-Cre大鼠模型构建设计方案
靶点1: R-Mbp-EA-gRNAup: TAGGTGCCCACCCAGCTGACCC R- Mbp-EA-gRNAdown: AAACGGGTCAGCTGGGTGGGCA
GGCGCTTCTTTAGCGGTGAC AGG R-Mbp-EB-gRNAup: TAGGCGCTTCTTTAGCGGTGAC R- Mbp-EB-gRNAdown: AAACGTCACCGCTAAAGAAGCG 合成的sgRNA单链通过退火复性结合成小片段,插入BSA I线性化的载体,构建完成的sgRNA载体通过体外转录成为可注射的sgRNA。
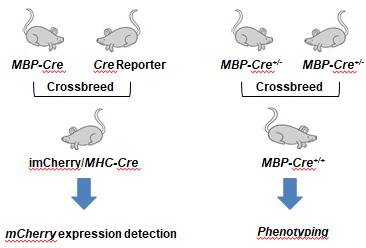
3.1.5.2 动物繁殖和表达图谱分析 获得F0代后,首先通过与野生型大鼠进行杂交,进行基因修饰大鼠传代能力分析。该模型包含Cre重组酶,可以同时与Cre reporter大鼠(SD.Rosa26(tm-imCherry)-GC/ILAS,http://www.ratresource.com)进行杂交,得到imCherry/MHC-Cre大鼠,进行表达图谱分析。之后MBP-Cre大鼠通过杂合子与杂合子杂交,获得MBP-Cre纯合子大鼠,进行蛋白表达分析,并用于后续实验。
图 2. MBP-Cre大鼠的繁育
3.1.5.3 鼠尾基因组DNA提取 在幼崽出生后剪脚趾标记,收集幼崽脚趾至1.5 mL EP管。然后参照DNA提取试剂盒(全式金)说明书按以下程序操作。
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
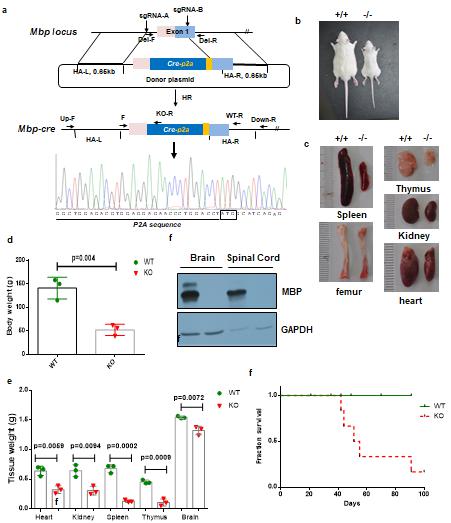
| 模型表型数据 | 4.1 MBP-Cre大鼠模型的建立 利用CRISPR/Cas9在MBP的起始密码子之前插入Cre重组酶元件。出生的小鼠经过设计的包含同源臂的引物(Table1),进行基因型鉴定,并进行插入序列的测序,最终获得了正确基因插入的大鼠图3-a所示。随后,我们通过杂合子杂交的方式获得了MBP-Cre双阳的大鼠,我们分析了1月龄大鼠体重和脏器发育相关指标,图3-b,c,d,e显示,双阳性大鼠在生长发育过程中,存在明显的生长停滞显现。各个脏器相比于野生型大鼠存在明显的减小。结果表明Cre的插入造成了的基因的突变。 随后我们进行了western blot表达分析,结果显示该基因的表达在大脑和脊髓中都没有表达图3-f所示,表明Cre的插入破坏了MBP基因的表达,该大鼠可以作为一个MBP敲除大鼠模型。
图3 MBP-Cre大鼠的建立
Table 1 本文中用于基因型鉴定的引物信息
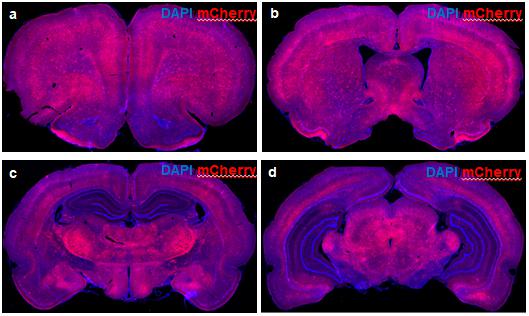
4.2 MBP在大鼠脑组织中的表达分析 由于在该基因起始位置插入了Cre重组酶,该重组酶的表达利用MBP内源启动子,因此,Cre的表达能够代表MBP基因的表达图谱。我们通过将MBP-Cre大鼠与与Cre reporter大鼠(SD.Rosa26(tm-imCherry)-GC/ILAS,http://www.ratresource.com)进行杂交,得到imCherry/MHC-Cre大鼠,进行表达图谱分析。结果如图4所示,表明MBP在大脑中存在着非常特异的的表达图谱。
图4 MBP-Cre介导的mCherry表达图谱
4.3 MBP敲除大鼠的出生情况统计 我们对该基因敲除大鼠的出生情况进行了统计,结果表明该基因敲除不影响生殖,通过杂合杂交的方式,敲除大鼠和野生型大鼠的出生比例基本一致,符合孟德尔自由分离和自由组合规律(Table 2所示)。 Table 2 MBP敲除大鼠出生情况统计
WT:wild type; KO: knockout; HET: Heterozygous
4.4 MBP敲除大鼠的生存率分析 上述结果表明我们成功建立了MBP敲除大鼠,并且该敲除大鼠表现为生长发育迟滞,后期伴随后肢瘫痪。随后我们对MBP敲除大鼠进行了生存率分析,图3-f所示,结果表明该基因敲除在40天左右开始出现死亡,在100天时死亡率到达80%以上。
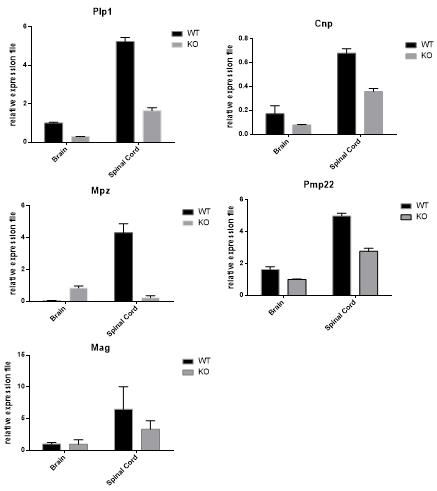
4.5 MBP敲除大鼠脑和脊髓中髓鞘相关蛋白的表达情况分析 我们对1月龄MBP敲除大鼠,进行脑组织和脊髓组织取材,分析了大脑和脊髓组织中髓鞘相关基因的表达情况。引物见Table 3所示,表达情况如图5所示。结果表明Plp1、Cnp、Pmp22在脑组织和脊髓组织表达都有明显降低。Mpz基因在脊髓中表达明显降低,但在大脑中表达反而升高,Mag的表达在脑中变化并不明显,但在脊髓中表现为表达降低。这样该基因的敲除小鼠存在一定的差异,表明该大鼠可以作为新的模型,与小鼠、人类该类疾病进行比较医学研究。 Table 3 Realtime PCR引物
图5 髓鞘相关蛋白在脑和脊髓中的表达情况分析
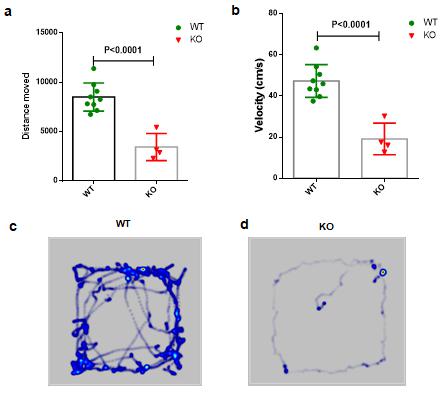
4.6 MBP敲除大鼠行为学分析 MBP基因敲除后,在10日龄左右,开始表现出颤抖和运动平衡障碍,一直持续要死亡,或最后演变为多发性硬化。我们对1月龄大鼠进行了视频拍摄,具体如图6所示(视频)。我们并对月龄左右的敲除大鼠进行了运动能力的测试,如图7所示。
图6 MBP敲除大鼠运动视频
图7 MBP敲除大鼠的行为学检测
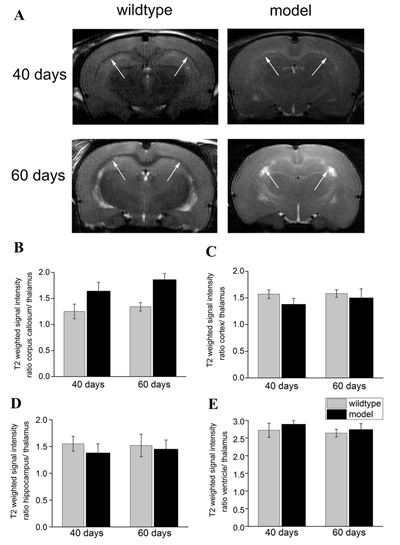
4.7 MBP敲除大鼠MRI检测分析 对40天和60天的MBP敲除大鼠和野生型大鼠进行了MRI分析,如图8所示。T2-weighted数据显示,在胼胝体位置MBP敲除大鼠高于野生型大鼠。
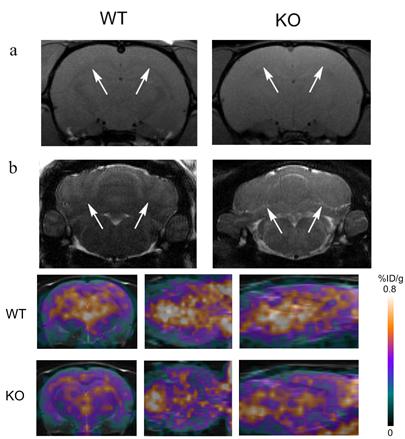
图8 MBP敲除和野生型对照在40天龄和60天龄的MRI分析 4.8 MBP敲除大鼠利用18F-FDG进行PET/CT影响分析 我们利用18F-FDG进行脑糖代谢能量标记,进行PET/CT分析,如图9所示。结果表明18F-FDG在下丘脑和海马中的吸收相比于野生型有明显的降低。
图9 18F-FDG进行脑糖代谢能量标记的PET和MRI影像图 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 动物模型的评价与验证 | 评价该动物模型中采用的生理、生化和病理方法,包括行为、影像、生理生化和组织切片等技术方法及评价模型成功的指标进行详细介绍。采用的仪器设备应满足模型评价的要求,指标完善,条件稳定。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 保存方式 | 活体繁殖 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 合作方式 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 相关文章 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 备注 |



 京公网安备 11010502043083号
京公网安备 11010502043083号