| 标识符 | CSTR:16397.09.0H01000738 |
|---|---|
| 资源中文名称 | 6-OHDA大鼠PD模型 |
| 资源英文名称 | |
| 疾病概述 | 帕金森病(Parkinson’s disease,PD) 临床症状主要表现为震颤、肌强直、运动减少、姿势及步态不稳等。 病理表现主要为中脑部位黑质纹状体多巴胺能神经元损害和出现神经元胞浆Lewy小体。 发病机制主要包括9种学说,即基因因素,蛋白质错误折叠和聚集,氧化应激反应,神经毒性物质,线粒体缺损,小神经胶质细胞活性,营养因子缺损,基底核排出物过度活跃,细胞程序性死亡。 |
| 实验动物背景信息 | 6-OHDA的化学结构类似于多巴胺,可被摄入到神经元内导致多巴胺能神经元的死亡,不透过血脑屏障,需要脑内注射。6-OHDA制作PD动物模型涉及的毒理机制为:(1)6-OHDA引起大规模氧化应激反应导致神经损伤;(2)6-OHDA可抑制线粒体呼吸酶复合体活性从而抑制其呼吸链的功能,进而引起细胞凋亡;(3)6-OHDA注入黑质纹状体内介导炎性反应使之出现损伤;(4)6-OHDA可同时影响其他基底神经节的代谢活动并导致细胞内Ca2+的超载。Ungerstedt等向大鼠脑内注射6-OHDA后成功建立了PD动物模型。6-OHDA应用于小鼠、狗、猫、猴等也可建立PD动物模型,但敏感性各有差异,大鼠最敏感也最常用。选择不同的注射部位、剂量和浓度,可制成完全损伤和部分损伤模型,也可制成早、中、晚期的PD动物模型。如完全损伤模型可导致神经元发生急性坏死,模拟PD的晚期特征,但动物的死亡率很高,故常采用单侧小剂量损毁来模拟PD的早、中期特征,此方法使模型更接近于人类。此模型与人类PD在生化、病理等方面较相近,经济易行,行为学改变稳定且便于观察,是目前唯一可进行行为学量化检测的模型,为研究PD的病机与治疗(包括药物、脑移植和基因治疗等)提供了理想模型,因而得以广泛应用。但此模型仍属急性损伤模型,无路易小体的形成并可对其他神经元产生非特异性损伤。 |
| 模型制作方法 | 1、模型制作 主要设备:脑立体定位仪、微量注射器、微型手持式颅钻、气体麻醉机、棉签、手术器械(持针器、手术刀柄、眼科剪、眼科镊、无菌缝合针线) 主要试剂:6-OHDA、生理盐水、75%乙醇、阿扑吗啡 材料:200g雄性SD大鼠 手术流程: (1)将大鼠置于气体麻醉机诱导箱内麻醉平稳后,俯卧平头颅位固定于小动物脑立体定位仪上。 (2)75%酒精消毒手术部位,减去头部顶毛,再次酒精消毒。 (3)沿颅顶正中切开动物皮肤,将颅骨表面的结缔组织膜除净,使前、后囟暴露清晰,少量出血时可用无菌棉签压迫止血。 (4)用规格为10μL的微量注射器抽取5μL的6-OHDA工作液,垂直固定于脑立体定位仪上,参照Paxinos&Watson大鼠脑立体定位图谱,选取大鼠单侧两点内侧前脑束(MFB)的注射坐标与体积为:①TB=-2.3mm,L=+1.2mm,AP=-4.4mm,DV=-8.2mm,2.5μL(7.5μg);②TB=+3.4mm,L=+0.8mm,AP=-4.0mm,DV=-8.4mm,2.0μL(6μg)。将前囟作为标准参考点,读取并标记注射靶点。 (5)于标记处使用钻头钻开颅骨,微量注射器沿钻孔垂直进针,向注射靶点内推注6-OHDA工作液,推注速度0.5μL/min,进出针速度1mm/min,留针5min。 (6)消毒伤口,缝合皮肤,将动物置于安静保温处,清醒后自由进食饮水。 |
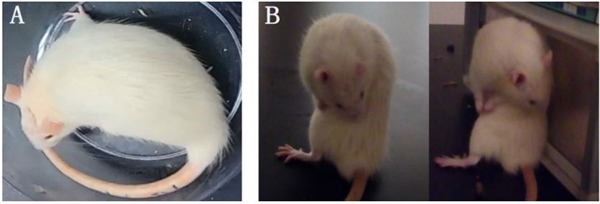
| 模型表型数据 | 2、行为学检测 阿扑吗啡(APO)诱导旋转测试 造模手术3周后,对大鼠进行APO诱导旋转测试筛选,腹腔注射APO(0.5mg/kg)诱导大鼠向健侧旋转,每周一次,共筛选三周,将30min内旋转次数达210转以上者列为成功模型。
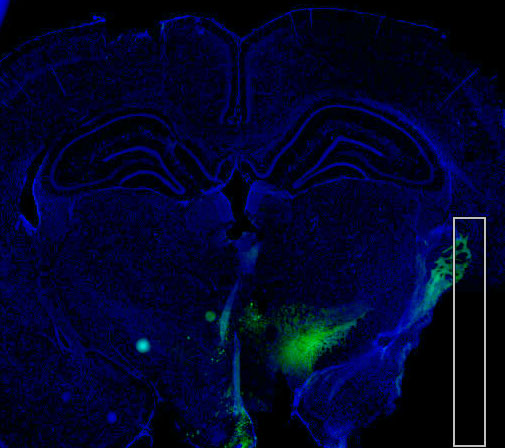
图 1 阿扑吗啡诱导旋转测试的大鼠行为表现 Fig1.The behavior of the rats in the APO induced rotation test. A.大鼠向健侧旋转,首尾相接记为一圈;B.大鼠偶有刻板动作、身体轴性扭转、头与上肢来回摆动并张口等异常不自主运动。 3、免疫组织化学染色观察大鼠黑质 TH+神经元 挑取黑质部位切片进行 TH+神经元免疫组织化学染色,如图2。
图2. 正常大鼠黑质内 TH+神经元荧光染色(绿色)。 |
| 动物模型的评价与验证 | |
| 保存方式 | |
| 合作方式 | |
| 相关文章 | |
| 备注 |


 京公网安备 11010502043083号
京公网安备 11010502043083号