| 标识符 | CSTR:16397.09.0H01001228 |
|---|---|
| 资源中文名称 | APP London swedish双突变小鼠 |
| 资源英文名称 | |
| 疾病概述 | 阿尔兹海默病(Alzheimer’s disease, AD)是最常见的神经退行性疾病,也是最常见的痴呆疾病(dementia),随年龄的增长其发病率逐渐增加。阿尔兹海默病的致病机制尚不明确,主要分为家族性阿尔兹海默病(familial AD, FAD)和散发性阿尔兹海默病(sporadic AD, sAD)。疾病的病理表现集中在神经元之间的淀粉样蛋白斑块沉积,神经元细胞内的磷酸化Tau蛋白和神经原纤维缠结,海马区和新皮层区弥散性的神经元丢失。 |
| 实验动物背景信息 | 淀粉样蛋白斑块(Amyloid plaques)是β-淀粉样蛋白(β-amyloid, Aβ)的沉积,是AD的典型病理特征。 淀粉样前体蛋白(Amyloid precursor protein, APP)属于I型跨膜蛋白,人类APP基因位于21号染色体,共18个外显子,约100~130kb。研究发现APP可在神经系统发育过程中发挥重要功能,但具体生理作用尚未清楚。APP可被α-,β-和γ-分泌酶(secretase)剪切,形成细胞外α-,β-和γ-淀粉样蛋白的病理特征。APP基因的突变与早发性家族性AD(familial AD, FAD)密切相关. Aβ蛋白是APP的水解形式,需要经过β-和γ-分泌酶(secretase)的剪切。首先,β-分泌酶剪切APP形成Aβ的N端,得到膜结合片段C99和分泌型APP胞外域APPsβ。随后,C99经γ-分泌酶剪切,产生Aβ的C端。γ-分泌酶的剪切不是精确剪切,可生成一系列Aβ多肽,其长度分别为38-43个氨基酸不等。一般情况下产生的Aβ40较多,Aβ42较少。Aβ42蛋白与短的Aβ蛋白相比更易产生纤维,Aβ42浓度增加与淀粉样蛋白斑块的不溶性纤维形成有关。已有大量证据表明早发型家族性AD与Aβ42蛋白相关,提示Aβ42在AD过程中发挥病因学作用。常染色体显性突变的APP、PS1、PS2基因与Aβ42蛋白的表达增高有关,并引起FAD。FAD中突变型的APP容易出现在β-或γ-分泌酶结合位点附近的聚集,导致Aβ总量增加(见于K670N/M671L瑞典型突变(Mullan M, Crawford F, Houlden H, Axelman K, Lilius L, Winblad B, Lannfelt L (1992) A pathogenic mutation for probable Alzheimer’s disease in the APP gene at the N-terminus of beta-amyloid. Nat Genet 1:345–347)或Aβ42增加(见于I716V佛罗里达型突变(Eckman CB, Mehta ND, Crook R, Perez-tur J, Prihar G, Pfeiffer E, Graff-Radford N, Hinder P, Yager D, Zenk B, Refolo LM, Prada CM, Younkin SG, Hutton M, Hardy J (1997) A new pathogenic mutation in the APP gene (I716V) increases the relative proportion of A beta 42(43).HumMol Genet 6:2087–2089.)和V717I伦敦型突变(Goate et al., 1991))。PS1和PS2是γ-分泌酶复合体的亚基,FAD的早老素presenilin突变也促进Aβ42增加。 |
| 模型制作方法 |
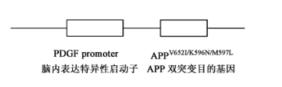
图:模型制作示意图 将London/Swedish双突变APP基因插入到PDGF启动子下游,构建转基因表达载体,通过显微注射法建立APP695V652I/K596N/M597L双突变转基因C57BL/6J小鼠。用显微注射法将线性化的转基因载体注射到C57BL/6J小鼠的受精卵中,转入到假孕受体ICR小鼠中。 |
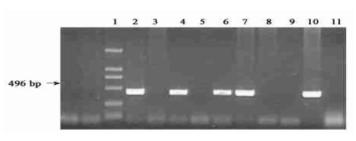
| 模型表型数据 | 小鼠出生后9~14 d提取基因组DNA,用PCR检测APP转基因小鼠( 图2) , 共得到4只首建鼠。 PCR引物为: 5’-CTAGTTCTGCATCTGCTCAAAG-3’ 5’-GACTCTGTGCCAGCCAACAC-3’
图:PCR鉴定APP转基因动物的凝胶电泳分析 第1泳道:DNA 2000 Marker 第2泳道:阳性对照 第4,6,7,10泳道:四只首建鼠(小鼠编号为18,31,36,37号)
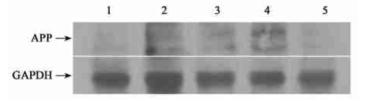
六、APP突变基因在蛋白水平的表达 Western blot结果显示,4个首建鼠的F1代均有人源APP蛋白表达,而其中有两组为高表达,分别是18号和31号首建鼠。
图:Western blot检测APP突变蛋白的表达水平
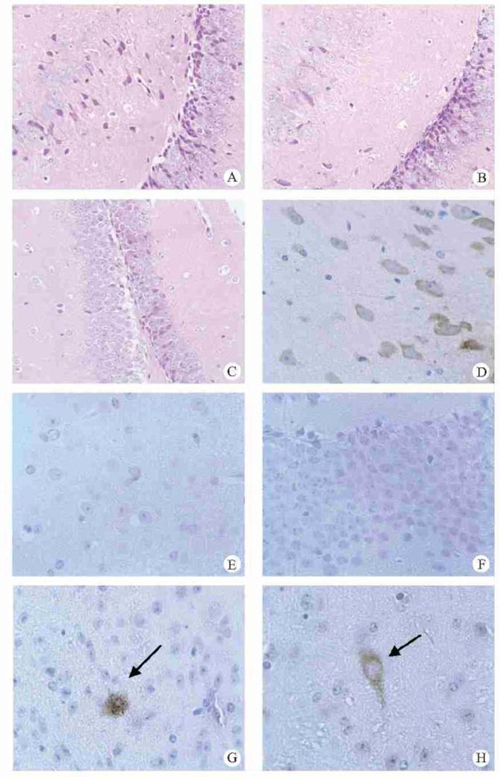
七、模型小鼠大脑病理改变 3月龄和5月龄的双突变的APP695V652I/K596N/M597L转基因小鼠、单突变的APP695V652I转基因小鼠和野生型小鼠相比较,HE染色未见明显差异。 抗Aβ1-17抗体的免疫组织分析显示,在3月和5月龄时,双突变阳性小鼠海马区均出现大量表达,同月龄单突变阳性小鼠和野生型小鼠未见同类变化。 5月龄的双突变阳性小鼠大脑皮层出现老年斑,同月龄单突变阳性小鼠未出现老年斑。
图:APP转基因小鼠的病理分析 A. 3月龄双突变转基因小鼠脑组织的HE染色(200×) B. 3月龄单突变转基因小鼠脑组织的HE染色(200×) C. 3月龄野生型小鼠脑组织的HE染色(200×) D. 5月龄单突变转基因小鼠脑组织免疫组化(400×) E. 5月龄单突变转基因小鼠脑组织免疫组化(400×) F. 野生型小鼠脑组织免疫组化(400×) G. 5月龄双突变转基因小鼠免疫组化(400×),箭头所示为老年斑 H. 5月龄双突变转基因小鼠免疫组化(400×),箭头所示为APP阳性神经元
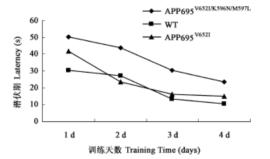
八、行为学结果 对3月龄双突变转基因小鼠、单突变转基因小鼠及野生型小鼠进行水迷宫隐藏平台实验,结果显示双突变小鼠比野生型小鼠潜伏期延长2倍以上,比单突变小鼠延长约1倍。
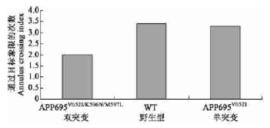
图:隐藏平台水迷宫,小鼠找到隐藏平台的平均潜伏期 水迷宫探索实验显示,双突变小鼠、单突变小鼠及野生型小鼠三组在穿越目标象限的次数同样有明显差异,双突变小鼠比野生型减少44%。
图:水迷宫探索实验,小鼠通过目标象限的次数 |
| 动物模型的评价与验证 | |
| 保存方式 | |
| 合作方式 | |
| 相关文章 | [1] 方瑾,马春梅,黄澜,刘亚莉,宗圆媛,全雄志,李万波,秦川.London/Swedish双突变APP转基因小鼠的鉴定[J].中国比较医学杂志,2008(05):24-27+36+82. |
| 备注 |


 京公网安备 11010502043083号
京公网安备 11010502043083号