| 标识符 | CSTR:16397.09.0I01000742 |
|---|---|
| 资源中文名称 | 外源性补充Hcy诱导伴高同型半胱氨酸血症的小鼠动脉粥样硬化模型 |
| 资源英文名称 | |
| 疾病概述 | 动脉粥样硬化的形成最初是由于内皮损伤造成,因为动脉粥样硬化的产生与血管舒张功能受损密切相关。在动脉粥样硬化形成早期,即可发生血管内皮依赖性舒张功能受损的现象,而在恢复期,也是血管内皮依赖性舒张功能首先恢复。由此可见,内皮损伤与动脉粥样硬化的形成有着密切的联系。而导致血管内皮损伤的一大危害因素就是高同型半胱氨酸血症。这是由于同型半胱氨酸血症不仅能抑制谷胱甘肽氧化酶的活性,促进过氧化物的形成,而且在氧化过程中还能产生大量超氧化阴离子、羟基和过氧化氢等氧活性物质,损害内皮细胞,降低血管的弹性。除此以外,高同型半胱氨酸血症还可以诱导细胞粘附分子和趋化因子的表达,从而促进动脉粥样硬化形成的早期事件——单核细胞粘附于血管内皮细胞,并迁入内皮摄取脂质转化为泡沫细胞的发生。也就是说,高同型半胱氨酸血症能够诱导动脉粥样硬化的产生。 |
| 实验动物背景信息 | 1.ApoE-/-小鼠,专业名称:C57(ApoE-/-),近交系(Inbred Rat) 品系来源 :(1)遗传背景及亚系:1921年Ltle用 Abbg Lathrop的小鼠株雌鼠57号与雄鼠52号交配,而得C57BL6。亚系:C57BL6、C57B/6、C57BL/6N等。 (2)毛色基因标记:aa、BB、CC(黑色) (3)主要遗传学特征:a免疫学特征:一般饲养条件下免疫球蛋白的量随年龄而增加,而到生后20个月时则1gG增长缓慢,无菌饲养的绝对量较低。gM水平较高,出生12月以后,有的个体超过80ug/mL。无菌饲养的动物lgM量比一般饲养的高。细胞免疫低下者少见,这可能与自发肿瘤少有关。b。形态学特征:在新生鼠中,雌鼠为16.8%,雄鼠3%为小眼或无眼症。0.6%后肢可见多趾症,另外水头症占2%4%,耳头症占0.4%,交合不全占3%。c生理学特性:有强嗜酒精性。对放射性照射为中等强度感应度,LD50为630+4R,将雄鼠皮肤移植到同系的雌鼠身上,约20日被排斥掉,这是因为在组织相容性抗原中的雄抗原在C57BL中非常显著。d癌发生率:乳癌发生率低,为01%,白血病为7%-16%化学致癌成功率低,放射性照射较容易诱发肝癌。 2.盐敏感对照大鼠SS-13BN Rat,专业名称:SS-Chr13BN/McwiCrlVr,同类系(Consomic Rat) |
| 模型制作方法 | 诱导方法:6周龄ApoE-/-小鼠正常饮食,在饮用水中添加DL-Hcy(1.8g/L),每三天更换一次,连续干预14周,每周称重一次,实验结束前,禁食4小时,取血液测量血生化等指标,取主动脉窦进行病理分析。 |
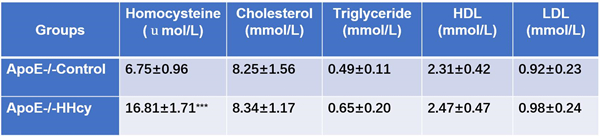
| 模型表型数据 | 1、血清生化指标变化
表1.血清中同型半胱氨酸,总胆固醇,甘油三脂,高密度脂蛋白及低密度脂蛋白水平检测。结果显示饮水中外源补充Hcy 的ApoE-/-HHcy组,血清同型半胱半胱氨酸水平明显升高,且不影响血脂水平。 *** 表示与 ApoE-/-Control组相比,P<0.01 。
2.主动脉窦病理结果  图1. 主动脉窦HE,油红O染色
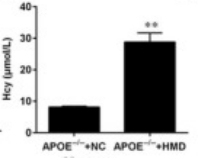
图2. Hcy诱导的VSMC增殖参与了动脉粥样硬化斑块的形成(通过自动生化分析仪测定APOE -/-小鼠的血清Hcy水平)。
图4. 蛋白质印迹法用于定量分析APOE -/- HMD和APOE -/-主动脉中PCNA,p27和Ki-67的蛋白表达NC小鼠。
|
| 动物模型的评价与验证 | |
| 保存方式 | |
| 合作方式 | |
| 相关文章 |
1.Dayal, S. and S.R. Lentz, Murine Models of Hyperhomocysteinemia and Their Vascular Phenotypes. Arteriosclerosis, Thrombosis, and Vascular Biology, 2008. 28(9): p. 1596-1605. 2.Homocysteine studies Collaboration. Homocysteine and risk of ischemic heart disease and stroke: a meta-analysis. JAMA. 2002;288:2015–2022. 3.Bonaa KH, Njolstad I, Ueland PM, Schirmer H, Tverdal A, Steigen T, Wang H, Nordrehaug JE, Arnesen E, Rasmussen K. Homocysteine lowering and cardiovascular events after acute myocardial infarction.N Engl J Med. 2006;354:1578 –1588. 4.Dayal S, Devlin AM, McCaw RB, Liu ML, Arning E, Bottiglieri T, Shane B, Faraci FM, Lentz SR. Cerebral vascular dysfunction in methionine synthase-deficient mice. Circulation. 2005;112:737–744. 5.Doshi SN, McDowell IF, Moat SJ, Payne N, Durrant HJ, Lewis MJ, Goodfellow J. Folic acid improves endothelial function in coronary artery disease via mechanisms largely independent of homocysteine lowering. Circulation. 2002;105:22–26. 6.Fu, Y., X. Wang and W. Kong, Hyperhomocysteinaemia and vascular injury: advances in mechanisms and drug targets. British Journal of Pharmacology, 2018. 175(8): p. 1173-1189. 7.Xu Long,Hao Hongyi,Hao Yinju et al. Aberrant MFN2 transcription facilitates homocysteine-induced VSMCs proliferation via the increased binding of c-Myc to DNMT1 in atherosclerosis.[J] .J. Cell. Mol. Med., 2019, 23: 4611-4626. |
| 备注 |




 京公网安备 11010502043083号
京公网安备 11010502043083号