| 标识符 | CSTR:16397.09.0L02001212 |
|---|---|
| 资源中文名称 | D5R基因敲出诱导盐敏感性高血压模型 |
| 资源英文名称 | |
| 疾病概述 | 高血压是由多基因、多环境因素及个人不良习惯相互作用而导致的一种慢性复杂疾病,也是危害人类健康的主要疾病之一。盐是高血压的重要环境因素,个体对盐负荷或限盐呈现不同的血压反应,因此存在盐敏感性问题[1]。盐敏感性是高血压、心脑血管病和其它疾病(如哮喘、胃癌和肾功能不全等)发病及致死的一个潜在危险因素[2]。因此在高血压临床诊治过程中,考虑盐敏感性将有利于对高血压分类、危险分级以及对症治疗。 |
| 实验动物背景信息 | 1.C57小鼠,专业名称:C57,近交系(Inbred Rat) 品系来源 :1)遗传背景及亚系:1921年Ltle用 Abbg Lathrop的小鼠株雌鼠57号与雄鼠52号交配,而得C57BL6。亚系:C57BL6、C57B/6、C57BL/6N等。 (2)毛色基因标记:aa、BB、CC(黑色) (3)主要遗传学特征:a免疫学特征:一般饲养条件下免疫球蛋白的量随年龄而增加,而到生后20个月时则1gG增长缓慢,无菌饲养的绝对量较低。gM水平较高,出生12月以后,有的个体超过80ug/mL。无菌饲养的动物lgM量比一般饲养的高。细胞免疫低下者少见,这可能与自发肿瘤少有关。b。形态学特征:在新生鼠中,雌鼠为16.8%,雄鼠3%为小眼或无眼症。0.6%后肢可见多趾症,另外水头症占2%4%,耳头症占0.4%,交合不全占3%。c生理学特性:有强嗜酒精性。对放射性照射为中等强度感应度,LD50为630+4R,将雄鼠皮肤移植到同系的雌鼠身上,约20日被排斥掉,这是因为在组织相容性抗原中的雄抗原在C57BL中非常显著。d癌发生率:乳癌发生率低,为01%,白血病为7%-16%化学致癌成功率低,放射性照射较容易诱发肝癌。 2.高血压对照小鼠:C57小鼠,专业名称:C57,同类系(Consomic Rat) |
| 模型制作方法 | 3.诱导方法:D5-/-小鼠的获得:首先获得构件打靶载体,利用同源重组技术把新霉素抗性基因反向插人到129/sv小鼠胚胎干细胞有D5受体表达的第二细胞内环基因序列中,抑制D5基因的表达,然后把基因打靶后的胚胎于细胞注射到c57BL/6小鼠胚泡,繁殖培育后产生纯合基因D5-/-.本实验应用的D5-/-小鼠第六代3-6个月龄的小鼠,对照(D5+/+)小鼠作为对照。6月龄D5-/-小鼠及其对照D5+/+,分别给予高盐饮食(4%的NaCl)和正常盐饮食(0.4%的NaCl),连续8周,每周测量血压。 |
| 模型表型数据 | 1、D5基因敲除及高盐饮食小鼠血压情况 高盐喂养8周后,通过左颈动脉插管法检测小鼠的血压,我们发现,Drd5多巴胺受体5受体敲出小鼠的血压相比于野生型小鼠明显升高。给予高盐饮食之后,多巴胺受体5受体(Drd5)敲出小鼠进一步升高。而野生型小鼠的血压没有明显升高。说明多巴胺受体5 (Drd5)受体敲出小鼠确实能够参与小鼠血压的调节。
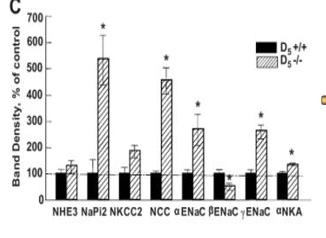
2、D5基因敲除小鼠肾脏NA离子转运蛋白的表达情况 为了进一步确定Drd5受体敲除后,小鼠肾脏钠离子转运蛋白表达情况,我们提取了D5+/+小鼠以及D5-/-小鼠肾脏组织的膜蛋白,我们发现与对照组D5+/+小鼠相比,基因敲除组D5-/-小鼠肾脏组织NaPi2、NCC、ENaC、NKA等蛋白的表达显著升高。这说明D5受体缺失之后,肾脏钠离子调控失调,致使大量钠离子聚集,进一步诱发钠水平衡失调以及高血压的发生发展。
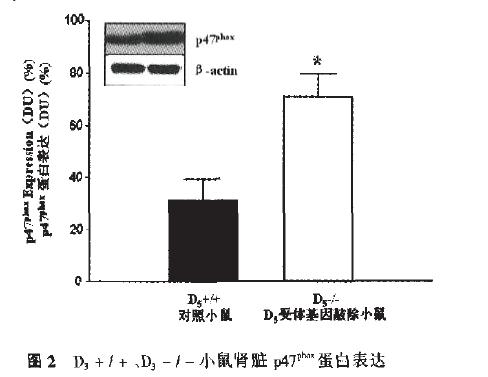
3、D5基因敲除小鼠NADPH氧化酶活性情况 为检测D5受体对NADPH氧化酶的影响,我们用第六代的D5-/-和D5+/+小鼠作为研究对象。ROS作为EH病理生理发生的一个因素,在心血管系统、肾脏中,主要是由NADPH氧化酶产生,因此,我们比较分析了D5-/-和D5+/+小鼠肾脏NADPH氧化酶的表达和活性。P47 (分子量47kDa)是肾脏NADPH氧化酶的细胞浆内的一个组成多肽,为此,我们检测P47的含量代表NADPH肾脏组织中的表达,结果显示:D5-/-鼠肾脏P47的表达量约是D5+/+小鼠的2倍。
进一步对NADPH氧化酶的活性测定发现:D5-/-小鼠肾脏NADPH氧化酶的活性明显高于和D5+/+小鼠,同时经DPI处理的标本,几乎检测不到NADPH氧化酶的活性,证明了检测NADPH氧化酶活性方法的特异性。分析结果表明,多巴胺通过D5,受体抑制NADPH氧化酶的表达和活性。
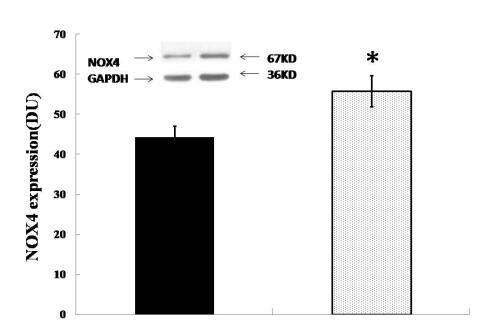
4、D5基因敲除小鼠ROS产生的情况 NOX家族均可诱导ROS的产生,定位于质膜上,可感受细胞外刺激信号,是信号分子的ROS主要来源。因此我们检测了肾脏组织膜蛋白NOX4表达的情况。蛋白印记结果显示,D5-/-小鼠肾脏NOX4的表达显著高于和D5+/+小鼠。肾脏NOX4的高表达也提示D5基因对肾脏ROS表达的调节作用,诱导肾脏组织损伤,进一步加剧高血压的发生发展。
|
| 动物模型的评价与验证 | |
| 保存方式 | |
| 合作方式 | |
| 相关文章 |
1. Cutler, J.A., et al., An overview of randomized trials of sodium reduction and blood pressure. Hypertension, 1991. 17(1 Suppl): p. I27-33. 2. de Wardener, H.E. and G.A. MacGregor, Harmful effects of dietary salt in addition to hypertension. J Hum Hypertens, 2002. 16(4): p. 213-23. 3. 刘治全, 血压的盐敏感性与盐敏感性高血压. 高血压杂志, 2005年3月. 13(3). 4. Weinberger, M.H., et al., Salt sensitivity, pulse pressure, and death in normal and hypertensive humans. Hypertension, 2001. 37(2 Part 2): p. 429-32. 5. Yatabe, M.S., et al., Salt sensitivity is associated with insulin resistance, sympathetic overactivity, and decreased suppression of circulating renin activity in lean patients with essential hypertension. Am J Clin Nutr, 2010. 92(1): p. 77-82. 6. Maron, B.J. and M.S. Maron, Hypertrophic cardiomyopathy. Lancet, 2013. 381(9862): p. 242-55. 7. Toepfer, C.N., et al., Hypertrophic cardiomyopathy mutations in MYBPC3 dysregulate myosin. Sci Transl Med, 2019. 11(476). |
| 备注 |




 京公网安备 11010502043083号
京公网安备 11010502043083号