| 标识符 | CSTR:16397.09.0H01001203 |
|---|---|
| 资源中文名称 | 脑室注射Aβ或脂多糖模型 |
| 资源英文名称 | |
| 疾病概述 | 老年性痴呆(Alzheimerps disease, AD)是一种神经退行性疾病,多发生于老年人,发病隐匿,病程长,发病机制不清楚,其主要的病理特征为老年斑形成和神经纤维缠结。β淀粉样蛋白(β-amyloid, Aβ)沉积是老年斑形成的主要原因,被认为是AD发病的关键。 |
| 实验动物背景信息 | 大鼠(体重260-300g),主要品种有SD和Wistar大鼠;小鼠(体重25-30g),主要品种有C57BL/6、ICR和Swiss albino小鼠。多用雄性,亦有雌雄各半。 |
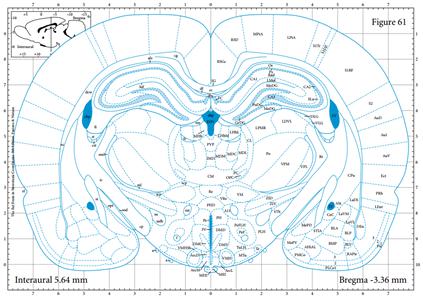
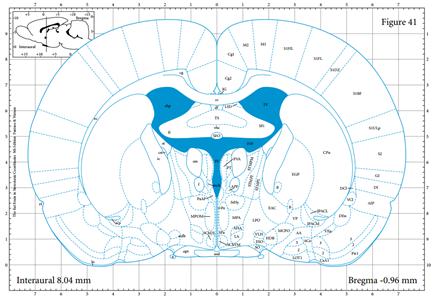
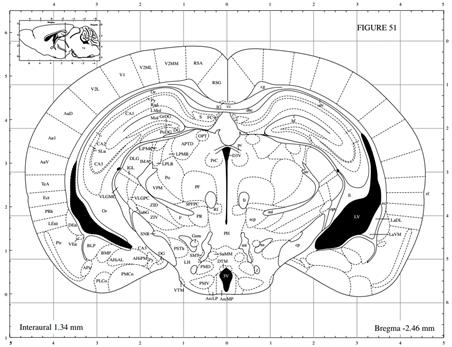
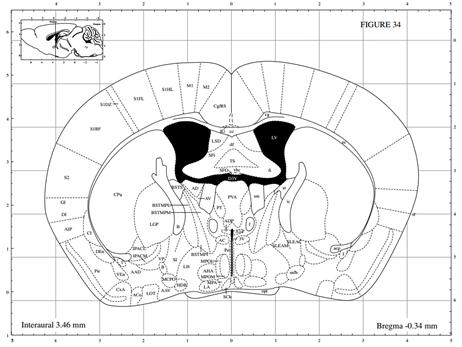
| 模型制作方法 | 1、药品与试剂 Amyloid β 蛋白片段1-40(也有采用Aβ1-28、Aβ1-42或者Aβ25-35);水合氯醛(或其它麻醉药物如戊巴比妥钠);无菌生理盐水(或PBS或双蒸水);H2O2溶液;青霉素钠粉。 脂多糖 (lipopolysaccharide,LPS),临用前配制成不同浓度备用,通常使用无菌生理盐水或人工脑脊液稀释,根据实验要求进行选择;麻醉药物水合氯醛或戊巴比妥钠;30% H2O2溶液;青霉素钠粉末或注射液。 2. 实验仪器 脑立体定位仪、微量注射泵、微量注射器、手术剪、手术镊子、缝合针线等。 3. 实验方法 3.1. 药品制备 Aβ1-40溶液:临用前将Aβ1-40溶于无菌生理盐水(或PBS或双蒸水)中配制成1 μg/μL母液,置于37 ℃孵育7天,使其聚集、老化,分装后,-20 ℃保存备用; 10%(m/v)水合氯醛溶液:称取水合氯醛10g,加入生理盐水定容至100 mL,备用。 3.2. 手术(以大鼠为例,小鼠操作参照此进行) (1)定位参照George Paxinos的脑立体定位图谱及预实验结果,基本步骤如下: (2)动物称重,用10%水合氯醛腹腔注射麻醉; (3)将大鼠头顶局部用动物去毛器去毛,消毒,并固定于脑立体定位仪上; (4)大鼠头顶处正中矢状切口,使用眼科剪剪开切口长约2cm,用棉棒沾少许H2O2清除骨膜,并用手术刀片将残物刮除干净暴露十字缝,确定前后囟,并使之处于同一平面; (5)坐标定位 大鼠: 海马:取前囟后AP:-3.3 mm,正中矢状缝左右旁开ML:±2.0 mm处使用牙科钻钻孔,进针深度为DV:3.0 mm (如图1A); 侧脑室:取前囟后AP:-0.9 mm,正中矢状缝左右旁开ML:±1.5 mm处使用牙科钻钻孔,进针深度为DV:3.8 mm(如图1B); 小鼠: 海马:取前囟后AP:-2.46 mm,正中矢状缝左右旁开ML:±2.2 mm处使用牙科钻钻孔,进针深度为DV:2.1 mm (如图2A); 侧脑室:取前囟后AP:-0.3 mm,正中矢状缝左右旁开ML:±1.0 mm处使用牙科钻钻孔,进针深度为DV:2.5 mm(如图2B); (以上坐标为较常见值,亦有许多其他坐标,实验坐标值以自己预实验结果为主。) (6)将微量注射器固定于注射泵臂上,缓慢插入钻孔,单侧海马注射Aβ1-40溶液5 μL,注射速度为1 μL/min,留针5min后缓慢撤针; (7)注射完毕后将青霉素钠盐少许撒于创口处缝合皮肤。 (8)动物手术后观察5-7天,剔除状态不好的动物。 4、行为实验 动物手术后观察5-7天,剔除状态不好的动物。利用行为学设备开展学习记忆行为实验检测。 A
B
图 1 大鼠脑立体定位图 (CA1-3海马CA1-3区,LV侧脑室) A
B
图 2 小鼠脑立体定位图 (CA1-3海马CA1-3区,LV侧脑室)
图 3 大鼠海马立体定位注射实物图
5. 注意事项 (1)模型建立应严格按照定位图谱进行,撤针时要求缓慢(5min),以防注射的注射药物通过针道溢出; (2) 采用冰冻切片,有利于快速病理染色以证实是否到达注射点; (3)取材时应取前囟后2~5 mm脑组织冠状切片,以防止取材过多或错过注射点。 6. 模型分析指标 6.1 水迷宫 圆形迷宫直径为159cm、高50cm,池中水深25. 5cm 左右,内置平台直径9cm、高24cm,水温维持在( 24 ± 1) ℃。将迷宫置于空间信息相对丰富的实验环境中,作为动物学习过程中的空间参照物,整个试验周期内保持环境信息固定不变。将迷宫均分为4个象限,将平台置于其中一个象限中央,作为实验中动物逃离水环境的唯一途径,空间记忆阶段保持平台位置固定不变。选择其余3个象限作为动物的入水点将动物面向池壁放入水中,每天训练3次,每次变换入水点位置( 使动物可分别从3个象限入水) ,且每天所有动物入水点的顺序保持一致。每次训练前适应10s,使动物获取并学习空间环境信息。设置检测时间为90s 后,将动物放入水中,若动物在90s 内找到平台,算作寻台成功并记录其潜伏期,并使其在平台上停留休息10s。若动物在90s内未找到平台,结束此次训练并记录潜伏期为90s,并引导动物靠近平台使其在平台上停留10s。每只动物训练的时间间隔为40min。每天每只动物3次训练学习的潜伏期平均值,作为评价动物这一天学习能力的指标。经过5d的训练学习后,第6天撤去平台,进行空间探索实验。将动物从原平台象限的对角象限面向池壁放入水中,检测其在90s内穿过原平台所在位置的次数,作为评价空间记忆能力的指标。 6.2 被动回避实验 实验包括获得、巩固两个部分 (1)避暗获得实验:睡眠干扰第27天进行避暗获得实验。实验前每只小鼠面向拱门由明室放入,适应3min。然后开始学习,将小鼠由明室背向拱门放入,当其进入暗室时,给予0.5mA(5s)的电击,共学习5min。 (2)巩固实验:获得实验24h后进行避暗巩固实验,仍将老鼠按原方式由明室放入,记录5min内的错误次数、进入暗室的潜伏期、在暗室停留时间等指标。实验后将老鼠取出,放回笼中。 |
| 模型表型数据 |
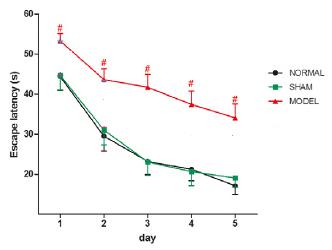
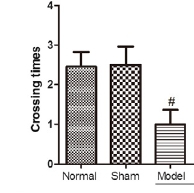
正常组与假手术组动物的寻台潜伏无显著性差异(P > 0.05),且接近;与正常组相比,模型组day1-day5寻台潜伏期显著性增加(P < 0.05),穿台次数显著性减少(P < 0.05)。
图4 脑室注射Aβ对水迷宫寻台潜伏期的影响
图5 脑室注射Aβ对水迷宫穿台次数的影响
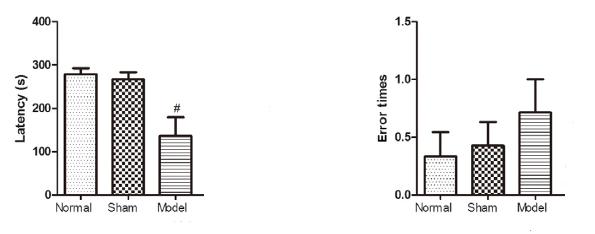
暗室潜伏期,正常组和假手术组无显著性区别(P > 0.05),与假手术组相比,模型组暗室潜伏期显著性下降(P < 0.05),错误次数模型组比假手术组有所增加,但无显著性差异(P > 0.05)。
|
| 动物模型的评价与验证 | |
| 保存方式 | |
| 合作方式 | |
| 相关文章 |
1. Pan Xu, KezhuWang, Cong Lu, Liming Dong, Li Gao, Ming Yan, SilafuAibai, Yanyan Yang, *Xinmin Liu. Protective effects of linalool against amyloid beta-induced cognitive deficits and damages in mice. Life Sci, 2017, 174: 21–27 2. Cong Lu, Zhe Shi, Xiuping Sun, Ruile Pan, Shanguang Chen, Yinghui Li, Lina Qu, Lihua Sun, Haixia Dang, Lanlan Bu, Lingling Chen, *Xinmin Liu. Kai Xin San aqueous extract improves Aβ1-40-induced cognitive deficits on adaptive behavior learning by enhancing memory-related molecules expression in the hippocampus. J Ethnopharmacol, 2017, 201:73–81 |
| 备注 |



 京公网安备 11010502043083号
京公网安备 11010502043083号