| 标识符 | CSTR:16397.09.0C01000816 |
|---|---|
| 资源中文名称 | 气管镜感染MERS-CoV恒河猴模型 |
| 资源英文名称 | |
| 疾病概述 | 2012 年6 月埃及病毒学家Zaki 从沙特一位患有急性肺炎并伴发急性肾衰竭的男性患者中分离到了一株冠状病毒。随后他把病毒样本送到了荷兰鹿特丹伊拉斯姆斯大学医学中心(Erasmus Medical Center),Ron Fouchier 教授最终证实的确是一种以前没有见过的冠状病毒,命名为 HCoV-EMC,是一种不同于SARS 冠状病毒(SARS-CoV)的新型冠状病。 随后英国的科学家也确认了一名来本国就医的卡塔尔患者也感染了这种新型冠状病毒,症状亦是严重呼吸综合征,将该病毒命名为人冠状病毒-England 1( human coronavirus England 1)。后续经证实两病例感染的病毒为同一病毒,序列比对有99.5%的相似性。 2012 年9 月23 日,世界卫生组织发布公告,确认有2 名患者感染了新型冠状病毒,两人临床表现为急性呼吸道感染,并伴有急性肾衰竭。此后几个月该病毒在中东地区接连出现,并出现了小群体传播事件。另外一些欧洲、美洲、非洲国家也出现来自中东的输入病例,分离的毒株也越来越多,并各自命名,比如 human betacoronavirus 2CJordan-N3、human betacoronavirus 2c England-Qatar 等。为统一新型冠状病毒名称,方便新型冠状病毒感染病例的通报,2013 年5月国际病毒分类委员会冠状病毒研究小组将此新型冠状病毒命名为中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus, MERS-CoV)。 |
| 实验动物背景信息 | 实验用恒河猴在实验室内传代三次以上,遗传背景明确,年龄为1-3岁。实验前进行血清学检查证明抗MERS抗体阴性。恒河猴在生物安全三级(BSL-3)实验室内饲养,并按国家动物生物安全标准操作规程进行操作。 |
| 模型制作方法 | MERS-CoV (hCoV-EMC,GenBank: MH454272.1)由荷兰伊拉斯姆斯大学医学中心Ron Fouchier 教授馈赠。采用支气管镜辅助攻毒,攻毒剂量为6.5×107TCID50/1ml/只。 观察攻毒后恒河猴临床症状,每天两次。分别于攻毒前1d和攻毒后3d、5d 进行肺部X光拍摄。攻毒后3天,MERS-CoV攻毒组安乐死2只恒河猴,对照组安乐死1只,采集肺、气管、心、脾、肾、脑、肝脏、肠组织进行病理、免疫组化和病毒检测。攻毒后分别在1, 3, 5, 7, 9, 11, 14, 21和28天采集咽拭子、鼻拭子、肛拭子进行病毒检测。并且在攻毒后7, 14, 21和28天采集血液分离血清,进行中和抗体检测。 |
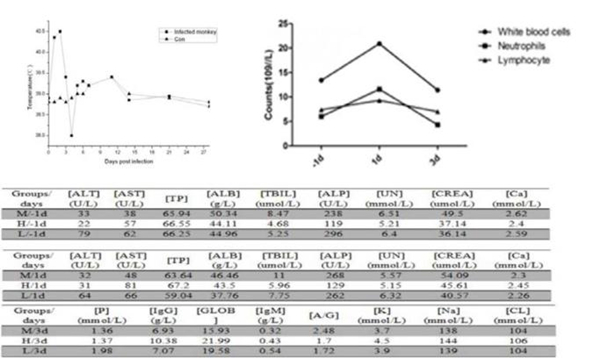
| 模型表型数据 | 1、MERS-CoV 感染恒河猴临床观察 MERS-CoV攻毒后,恒河猴表现了一定的感染症状,主要表现为攻毒后体温出现瞬时升高,即感染后1天、2天体温急剧上升,但3天时恢复正常(图1)。并且恒河猴在攻毒后饮水量减少,整个实验期内恒河猴体重并未有明显的变化,也没出现死亡现象。对攻毒后恒河猴进行了血常规检测,发现攻毒后1天,白细胞有瞬时升高,但3天时就恢复正常。另外还进行了肝功能和肾功能检测,结果发现攻毒前后并未发生改变。对照组恒河猴无任何临床症状。
图1 恒河猴MERS-CoV攻毒后临床症状变化
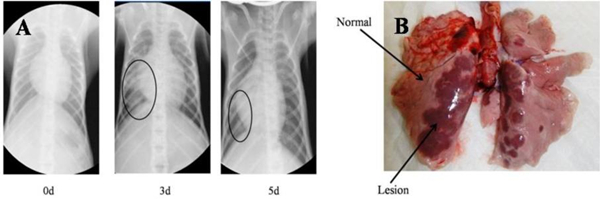
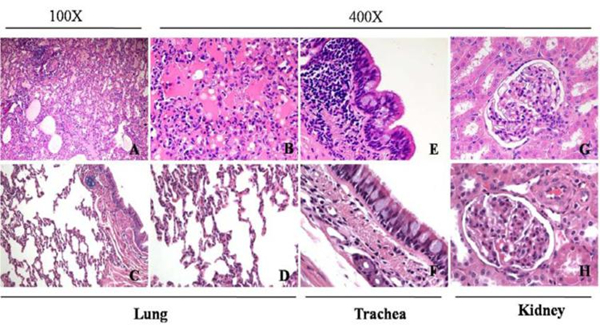
2、MERS-CoV感染恒河猴病理学检查 MERS-CoV感染前和感染后3天和5天分别进行了肺部X光拍摄,感染前肺部并未观察到任何变化,感染3天时肺右下出现阴影,表明肺部有炎症反应。5天时阴影面积有所减小,但仍存在(图2A)。MERS-CoV感染后3天,大体解剖可见恒河猴肺部有不同程度充血呈暗红色,其位置跟X光检查结果一致(图2B)。而对照组肺部无明显变化。显微病理检查可见攻毒组恒河猴出现间质性肺炎,表现为肺泡隔中度到重度增宽,以支气管为中心发生灶状实变,其中大量的炎性细胞浸润,以淋巴细胞、巨噬细胞为主,少量嗜中性粒细胞和浆细胞;血管淤血,伴有出血;支气管管腔中可见少量渗出和红细胞,而对照组无此变化(图3)。肺外其它组织未见明显的病理改变。免疫组化分析表明攻毒组恒河猴肺和气管中可检测到病毒蛋白的表达,阳性细胞主要分布在Ⅰ型、Ⅱ型肺泡细胞和巨噬细胞。肺外器官并未检测到病毒蛋白的存在。对照组猴肺中并未检测到病毒特异蛋白的存在(图4)。
图2 恒河猴胸透图(A)和肺大体解剖图(B)
C-D:正常组恒河猴肺组织,F:正常组恒河猴气管组织,H:正常组恒河猴肾组织)
3、qRT-PCR方法检测拭子和组织样品病毒载量 攻毒后分别对拭子样品和组织样品进行病毒核酸检测,结果发现攻毒后仅在肺部和气管检测到高的病毒载量,特别是攻毒后1天时,咽拭子也检测到了较高的病毒载量。而在其它组织和其它时间点拭子检测不到病毒核酸或很低的病毒载量存在。对照组恒河猴组织和拭子样品未检测到病毒核酸的存在(图5)。
图5 恒河猴肺组织和拭子病毒核酸载量检测
4、 拭子和组织样品中病毒滴度测定 对采集的鼻拭子、咽拭子、肛拭子在Vero细胞上进行病毒滴度测定,并未分离到病毒,与PCR检测检测结果一致。攻毒后3天,采集的组织样品也进行病毒分离,只在肺部和气管分离到病毒,肺部病毒滴度达101.67 TCID50/ml,气管病毒滴度达101.5 TCID50/ml。其他器官(肾脏、大脑、心脏、肝脏、脾脏和肠)并未分离到病毒。对照组恒河猴拭子和组织样品均未分离到病毒。
5、 MERS-CoV 感染后血清中和抗体检测 攻毒后7天、14天、21天和28天,采集感染组和对照组恒河猴血液,分离血清进行中和抗体检测。微量中和试验结果显示感染组恒河猴在攻毒后7d即可检测到中和抗体的存在,在感染后14d时达到高峰,可达1:320,之后抗体滴度稍微有所下降,在攻毒后28d时达到1:160。对照组血清中检测不到中和抗体的存在(图6)。
图6 MERS-CoV 攻毒后不同时间点中和抗体检测
|
| 动物模型的评价与验证 | |
| 保存方式 | |
| 合作方式 | |
| 相关文章 | [1] Yao Y, Bao L, Deng W, Xu L, Li F, Lv Q, Yu P, Chen T, Xu Y, Zhu H, Yuan J, Gu S, Wei Q, Chen H, Yuen KY, Qin C. An animal model of MERS produced by infection of rhesus macaques with MERS coronavirus. J Infect Dis. 2014 Jan 15;209(2):236-42. doi: 10.1093/infdis/jit590. |
| 备注 |


 京公网安备 11010502043083号
京公网安备 11010502043083号