| 标识符 | CSTR:16397.09.0l01001467 |
|---|---|
| 资源中文名称 | 壁细胞荧光示踪小鼠模型 |
| 资源英文名称 | The fluorescent living genetically engineered mouse model of mural cells |
| 疾病概述 | 胶质母细胞瘤(GBM)是最常见的颅内原发肿瘤,致死率高、预后差,急需探索新的治疗手段。胶质母细胞瘤的恶性增殖往往伴随着血管的病变及增生。血管主要由基底膜内的内皮细胞和基底膜外的壁细胞(血管平滑肌细胞和周细胞)组成。壁细胞作为血脑屏障的重要组成部分,除了维护生理状态下血管的结构与稳态,还在调节功能性血流量、启动新生血管形成和促进血管成熟中发挥重要作用。胶质瘤干细胞能够生成壁细胞来促进肿瘤增殖;壁细胞作为肿瘤微环境中的一部分,与肿瘤干细胞的相互转分化促进了肿瘤的转移与定植;壁细胞在胶质瘤中参与形成血肿瘤屏障,过滤了大多数抗癌药物和免疫细胞对肿瘤的浸润,靶向敲除后能够促进化疗药物的浸润。 |
| 实验动物背景信息 | C57BL/6小鼠 |
| 模型制作方法 | 1.1 Tamoxifen诱导条件性敲除PDGFRβ-Cre+/-: Rosa26-tdTomato+/-小鼠的构建 将壁细胞特异性PDGFRβ-Cre+/+小鼠(购自美国杰克逊实验室,stock no. 030201)与Rosa26-tdTomato+/+小鼠(购自美国杰克逊实验室,stock no. 007914)杂交,产生Tamoxifen诱导下壁细胞特异性表达tdTomato红色荧光蛋白的PDGFRβ-Cre+/-: Rosa26-tdTomato+/-小鼠。在无Tamoxifen诱导的情况下,PDGFRβ-CreERT2在细胞质内处于无活性状态;当Tamoxifen诱导后,Tamoxifen的代谢产物4-OHT(雌激素类似物)与ERT结合,可使PDGFRβ-CreERT2进核发挥Cre重组酶活性,切掉LoxP位点之间的终止位点,诱导tdTomato红色荧光蛋白表达。Tamoxifen诱导Cre酶剪切LoxP的原理如图1所示。 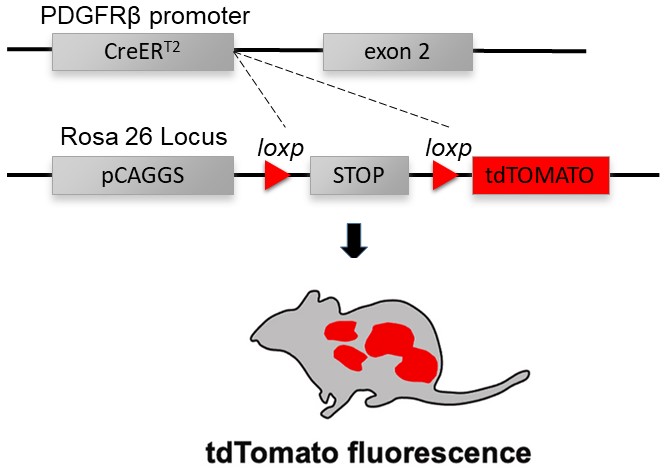 图1 Tamoxifen诱导Cre酶剪切LoxP表达tdTomato荧光原理
1.2玻璃颅窗动物模型的手术制备
采用8-12周的PDGFRβ-Cre+/-: Rosa26-tdTomato+/-小鼠进行实验,用异氟烷气体麻醉诱导,术中麻醉采用腹腔注射氯胺酮、甲苯嗪和盐酸苯甲酸盐(注射剂量0.0375/0.0375/0.000125 mg/g)麻醉小鼠。皮下注射青霉素(40 mg/kg)减少感染。小鼠麻醉完全后,使用脱毛膏除净小鼠头部的毛发。随后将小鼠固定在立体定位仪上。使用眼膏以避免小鼠眼部脱水和刺激去头皮,使用颅钻轻轻磨去颅骨,用镊子挑去硬脑膜(图2-A)。用直径6 mm的透明颅窗覆盖大脑,并用牙科水泥乙基氰基丙烯酸酯液体(以下简称牙科水泥)密封(图2-B)。术后皮下注射4针镇痛药:每隔6小时注射一剂美洛昔康注射液(0.1 mg/kg)。 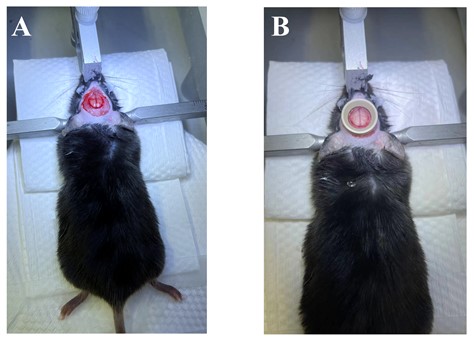 注:A:磨去小鼠颅骨的效果图;B:借助牙科水泥使用固定环与玻璃圆片替代小鼠的颅骨。
图2 小鼠的长期颅窗制备 1.3 双光子显微镜观察
图像采集使用徕卡TCS SP8 DIVE共聚焦显微镜,配备变色龙超激光系统(680-1300 nm)和25×水浸物镜(数值孔径0.95,徕卡)。单幅图像采集深度为0-300 μm, z-间隔为3 μm。FITC-dextran与TdTomato的激发波长为975 nm,为了显示脑血管,通过小鼠尾静脉注射10 mg/ml的FITC-dextran(2×106分子量,绿色,Sigma-Aldrich)0.2 ml。TdTomato的发射波长为570-640 nm,FITC-dextran的发射波长为500-550 nm。用异氟醚麻醉小鼠,以0.8% ~ 2.0%(根据小鼠身体状况尽可能低的流量)的恒定流量(1 ml/min)维持。激光功率也限制在最低百分比,尽量避免光毒性。 |
| 模型表型数据 | 2.1 PDGFRβ-Cre+/-:Rosa26-tdTomato+/-小鼠的表型分析 C57BL/6遗传背景的PDGFRβ+细胞特异性携带红色荧光的小鼠与C57BL/6小鼠的外观形态、生长速度、繁殖能力无明显差异。HE结果(图3)显示PDGFRβ-Cre+/-:Rosa26-tdTomato+/-小鼠与C57BL/6小鼠的脑、肺、心、肝、脾和肾等无明显差异。  图3 主要器官组织形态学分析 2.2 PDGFRβ-Cre+/-:Rosa26-tdTomato+/-小鼠各组织器官中壁细胞呈现红色荧光
连续3天以75 mg/kg剂量腹腔注射Tamoxifen,PDGFRβ+的细胞表达红色荧光蛋白需要7天左右的代谢期。图4显示PDGFRβ-Cre+/-:Rosa26-tdTomato+/-小鼠各组织器官中的壁细胞呈现红色荧光。 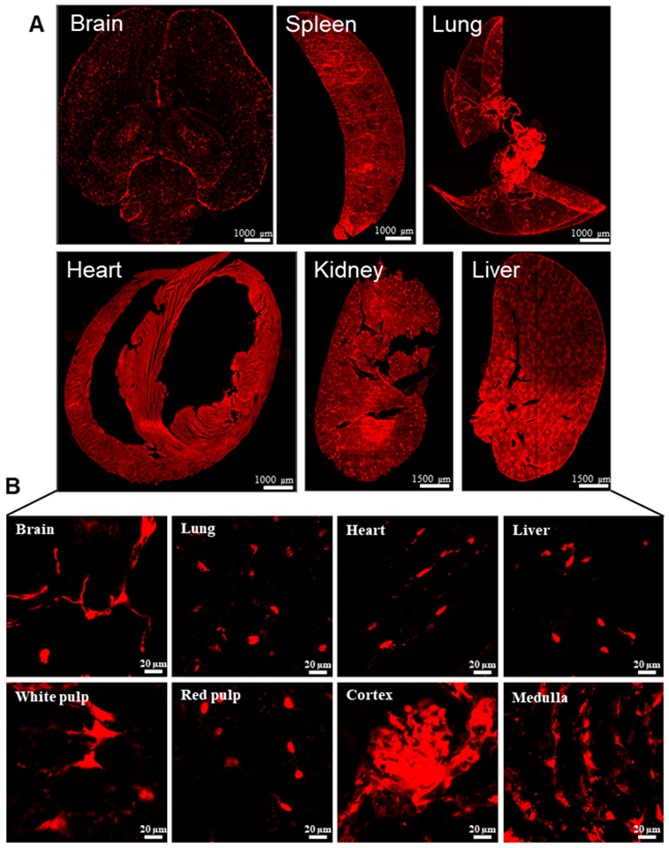 注:A:PDGFRβ-Cre+/-:Rosa26-tdTomato+/-小鼠各组织器官中壁细胞呈现红色荧光;B:各器官中壁细胞在63×显微镜下的成像。
图4 PDGFRβ-Cre+/-:Rosa26-tdTomato+/-小鼠各组织器官壁细胞表达红色荧光 3.动物模型鉴定方法※:
(请写明动物模型基因型鉴定方法及其他方法评价该动物模型的方法,如Genome Typing、Sequencing以及WB等) 3.1 PDGFRβ-Cre+/-: Rosa26-tdTomato+/-小鼠的基因型鉴定 PDGFR-β-Cre PCR引物:野生型引物:5'-AGC TTG TGG CAG TGT AGC TG-3';突变型引物:5'-ACA TGT CCA TCA GGT TCT TGC-3'。共用引物:5'-CCA CCT TGA ATG AAG TCA ACA C-3'。野生型等位基因的条带大小为272 bp,突变型等位基因的条带大小约为320 bp。 Rosa26-tdTomato PCR引物:野生型正向引物:5′-AAG GGA GCT GCA GTG GAG TA-3′,反向引物:5'-CCG AAA ATC TGT GGG AAG TC-3′。突变正向引物:5′- CTG TTC CTG TAC GGC ATG G-3',反向引物:5'-GGC ATT AAA GCA GCG TAT CC-3'。PCR反应产生了Rosa26-tdTomato突变等位基因约200 bp的片段,野生型等位基因约297 bp的片段。所有引物根据杰克逊实验室官网的序列订购自生工(Sango Biotech)。 PCR反应在20 μL反应中分别加入10 μL PreMix TaqTM(Takara 2.0 plus dye)、2 μL鼠尾基因组DNA、1 μL 10 nM前向引物和反向引物,最后加入6 μL ddH2O。对于PDGFRβ-Cre和Rosa26-tdTomato, PCR程序在95℃初始变性5 min, 95℃30 s, 58℃30 s, 72℃30 s的35个循环中运行,最后在72℃延长10 min。 如图5所示:A图为PDGFRβ-Cre突变型产物,条带位置在320 bp左右;B图为PDGFRβ-Cre野生型产物,条带位置在272 bp左右。A、B图中“+”为PDGFRβ-Cre突变型对照,“-”为野生型对照。经过鉴定,1号、12号样品为PDGFRβ-Cre-/-,2号样品为PDGFRβ-Cre+/+,3-11号样品为PDGFRβ-Cre+/-。C图为Rosa26-tdTomato的基因鉴定产物,条带位置在200 bp和297 bp左右,符合突变型等位基因和野生型等位基因的大小。1号、3号、4号为Rosa26-tdTomato+/-,2号、5号为Rosa26-tdTomato-/-。 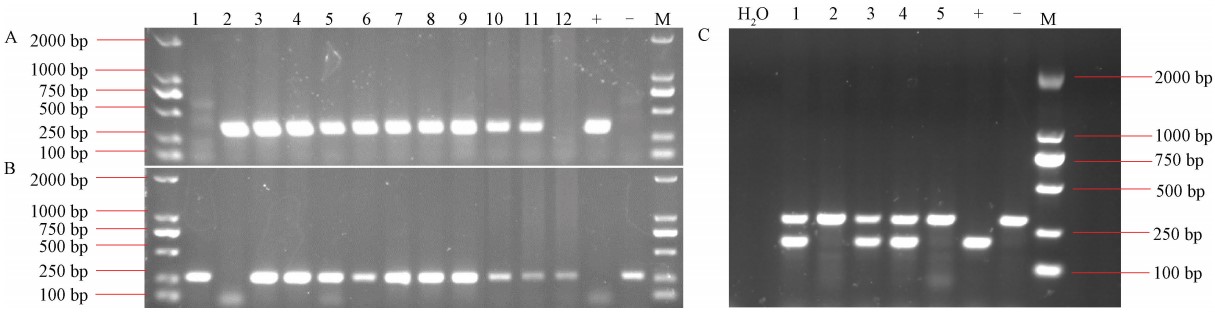 注:A:PDGFRβ-Cre突变型产物;B:PDGFRβ-Cre野生型产物;C: Rosa26-tdTomato基因鉴定产物。
图5 小鼠的基因型鉴定 3.2壁细胞荧光示踪小鼠模型的评价方法
通过PDGFRβ-Cre+/-: Rosa26-tdTomato+/-小鼠的颅窗观察到PDGFRβ+的细胞表达红色荧光蛋白需要7天左右的代谢期。于第-30天进行手术对PDGFRβ-Cre+/-:Rosa26-tdTomato+/-小鼠制备颅窗,第-2、-1、0天每天以75 mg/kg剂量腹腔注射Tamoxifen。第3天开始进行双光子动态跟踪拍摄,为了显示脑血管,通过小鼠尾静脉注射10 mg/ml的FITC-dextran(2×106分子量,绿色,Sigma-Aldrich)0.2 ml,使血管呈现绿色荧光。从第3天至第7天,可以观察到PDGFRβ-Cre诱导的tdTomato红色荧光蛋白表达逐渐增加(图6-A),至第7天以后PDGFRβ+细胞中红色荧光表达趋于稳定(图6-B)。壁细胞荧光示踪小鼠模型能够精确地从细胞层面完整地示踪脑血管与壁细胞的动态变化。 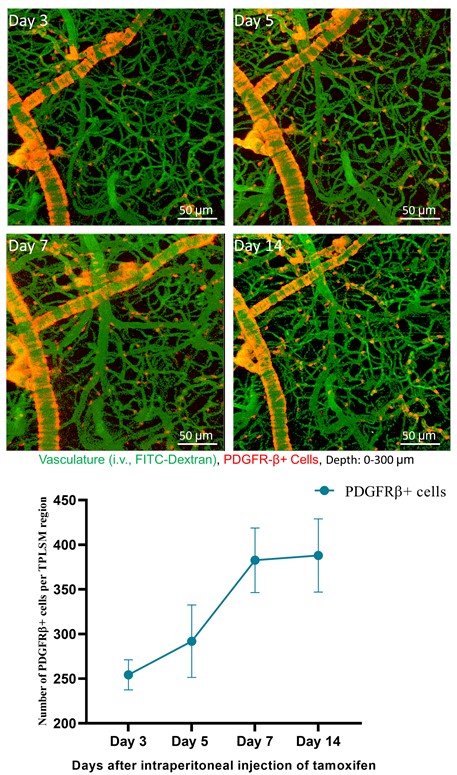 注:A:动态跟踪拍摄生理条件下血管(绿色)与壁细胞的(红色)的变化;B:拍摄区域壁细胞数量变化曲线(n=3)。 图6 使用PDGFRβ-Cre+/-:Rosa26-tdTomato+/-小鼠模型观察壁细胞与血管的效果 |
| 动物模型的评价与验证 | |
| 保存方式 | 冷冻 |
| 合作方式 | 不限定 |
| 相关文章 | 马铖延,杨星九,史旭东,等.双光子显微镜技术下胶质瘤-壁细胞在体多荧光示踪小鼠模型的建立及应用[J].中国实验动物学报,2024,32(6):702-711. |
| 备注 |


 京公网安备 11010502043083号
京公网安备 11010502043083号