| 标识符 | CSTR:16397.09.0l01001468 |
|---|---|
| 资源中文名称 | 双光子显微镜-胶质瘤荧光示踪小鼠模型 |
| 资源英文名称 | The fluorescent living genetically engineered mouse model of glioma |
| 疾病概述 | 胶质母细胞瘤(GBM)是最常见的颅内原发肿瘤,致死率高、预后差,急需探索新的治疗手段。胶质母细胞瘤的恶性增殖往往伴随着血管的病变及增生。血管主要由基底膜内的内皮细胞和基底膜外的壁细胞(血管平滑肌细胞和周细胞)组成。壁细胞作为血脑屏障的重要组成部分,除了维护生理状态下血管的结构与稳态,还在调节功能性血流量、启动新生血管形成和促进血管成熟中发挥重要作用。胶质瘤干细胞能够生成壁细胞来促进肿瘤增殖;壁细胞作为肿瘤微环境中的一部分,与肿瘤干细胞的相互转分化促进了肿瘤的转移与定植;壁细胞在胶质瘤中参与形成血肿瘤屏障,过滤了大多数抗癌药物和免疫细胞对肿瘤的浸润,靶向敲除后能够促进化疗药物的浸润。 |
| 实验动物背景信息 | C57BL/6小鼠 |
| 模型制作方法 | 1.1玻璃颅窗动物模型的手术制备 采用8-12周的小鼠进行实验,用异氟烷气体麻醉诱导,术中麻醉采用腹腔注射氯胺酮、甲苯嗪和盐酸苯甲酸盐(注射剂量0.0375/0.0375/0.000125 mg/g)麻醉小鼠。皮下注射青霉素(40 mg/kg)减少感染。小鼠麻醉完全后,使用脱毛膏除净小鼠头部的毛发。随后将小鼠固定在立体定位仪上。使用眼膏以避免小鼠眼部脱水和刺激。剪去头皮,使用颅钻轻轻磨去颅骨,用镊子挑去硬脑膜(图1-A)。用直径6 mm的透明颅窗覆盖大脑,并用牙科水泥乙基氰基丙烯酸酯液体(以下简称牙科水泥)密封(图1-B)。术后皮下注射4针镇痛药:每隔6小时注射一剂美洛昔康注射液(0.1 mg/kg)。 1.2胶质瘤活体动物模型制备方法 制备使用玻璃颅窗替代颅骨的小鼠,4周后除去小鼠脑表的玻璃片与固定环,用PBS制备2500 个/ μl的浓度GL261-CFP细胞悬液,使用10 µl的汉密尔顿微量注射器和2 pt型针头,与水平面成60°的方向将2 µl含5×103 GL-261-CFP细胞的细胞悬液以0.5 mm/min的速度立体定向注射到小鼠脑内(图1-C),进针深度1.5 mm,停留2分钟后,退至1 mm深度,以0.5 μl/min注射2 μl 肿瘤细胞悬液,注射完停针5 min后缓慢退针。注射点位于矢状窦外侧约1 mm,前囟前方约2 mm,脑实质内深度1 mm(图1-D)。注射完毕后停留5分钟后,以1 mm/min的速度退针。使用生理盐水清洁脑表,使用牙科水泥粘住玻璃圆片与固定环。术后皮下注射4针镇痛药:每隔6小时注射一剂美洛昔康注射液(0.1 mg/kg)。使用CFP慢病毒感染的GL261细胞用500 μg/ml G418筛选至CFP稳定表达,GL261-CFP在荧光显微镜下发出青蓝色荧光(图1-E)。 1.3 双光子显微镜观察 图像采集使用徕卡TCS SP8 DIVE共聚焦显微镜,配备变色龙超激光系统(680-1300 nm)和25×水浸物镜(数值孔径0.95,徕卡)。单幅图像采集深度为0-300 μm, z-间隔为3 μm。为了显示脑血管,通过小鼠尾静脉注射10 mg/ml的FITC-dextran(2×106分子量,绿色,Sigma-Aldrich)0.2 ml。FITC-dextran激发波长为975 nm, GL261-CFP激发波长为860 nm,1024×1024像素。FITC-dextran的发射波长为500-550 nm, GL261-CFP肿瘤细胞的发射波长为450-490 nm。用异氟醚麻醉小鼠,以0.8% ~ 2.0%(根据小鼠身体状况尽可能低的流量)的恒定流量(1 ml/min)维持。激光功率也限制在最低百分比,尽量避免光毒性。 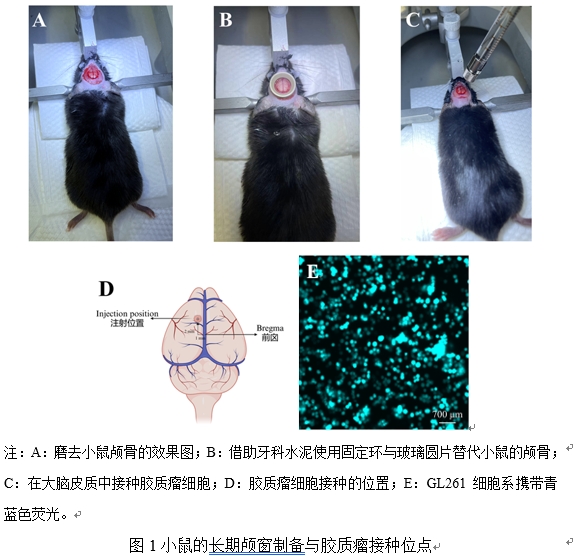 |
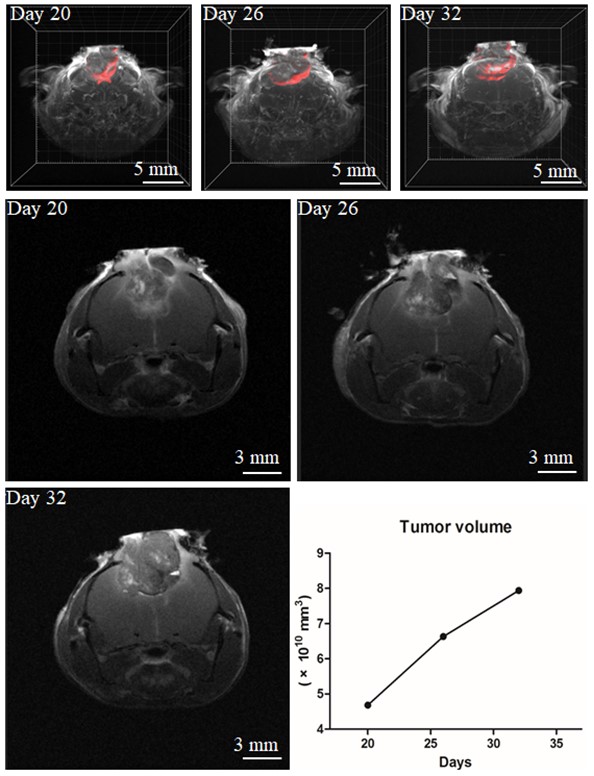
| 模型表型数据 | 2.1 双光子显微镜-胶质瘤荧光示踪小鼠模型 如图2-A所示,第7天通过双光子显微镜观察到胶质瘤侵袭增殖,肿瘤细胞GL261-CFP呈现青蓝色荧光,血管呈现绿色荧光;第10天观察到胶质瘤形成多发性病灶,第14天观察到胶质瘤占位明显,肿瘤内血管失去正常形态。选取3只小鼠第7天至第14天的300 μm×300 μm×300 μm 大小的区域跟踪分析统计,观察到胶质瘤内血管紊乱。至第14天,破碎的血管脉络增多、新生血管形成。小鼠脑胶质瘤的HE染色(虚线所示)可见多形性胶质瘤细胞,细胞核增大深染,胞浆嗜酸性染色阳性(图-2B)。 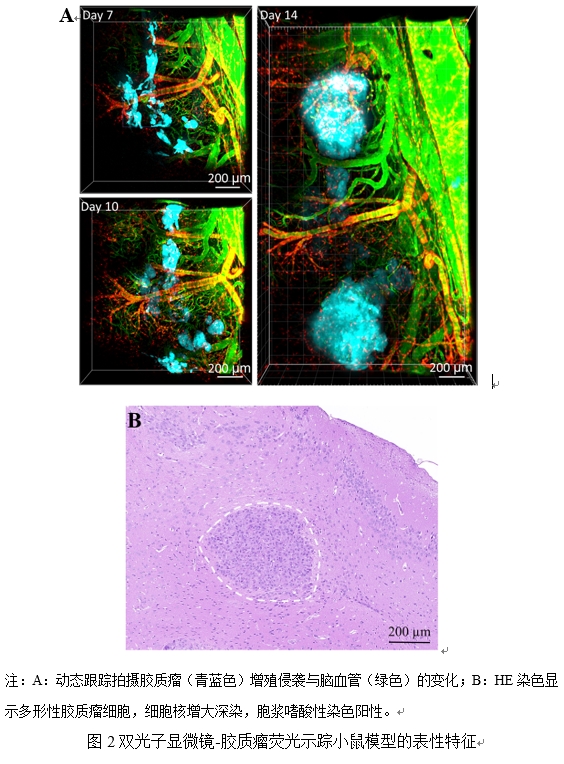 2.2 核磁成像跟踪小鼠胶质瘤生长变化
|
| 动物模型的评价与验证 | |
| 保存方式 | 冷冻 |
| 合作方式 | 不限定 |
| 相关文章 | 马铖延,杨星九,史旭东,等.双光子显微镜技术下胶质瘤-壁细胞在体多荧光示踪小鼠模型的建立及应用[J].中国实验动物学报,2024,32(6):702-711. |
| 备注 |


 京公网安备 11010502043083号
京公网安备 11010502043083号