| 标识符 | CSTR:16397.09.0G01001466 |
|---|---|
| 资源中文名称 | miR146a过表达小鼠 |
| 资源英文名称 | miR146a Tg mice |
| 疾病概述 | microRNAs(miRNAs)通过抑制靶基因的表达,在机体许多生理和病理过程中发挥重要作用。miR-146a是一种在脂多糖(LPS)刺激和病毒感染下诱导的miRNA,在类风湿性关节炎、舍格伦综合征和银屑病等免疫性疾病患者中也有高表达。miR-146a充当负反馈调节剂,并通过靶向各种先天细胞(如单核细胞、肺上皮肺泡细胞和小胶质细胞)中的IRAK 1/2和TRAF 6来抑制Toll样受体信号传导途径。这些研究表明,miR-146a在炎症和过继性免疫应答期间起着强大的“刹车”作用。 |
| 实验动物背景信息 | BALB/c小鼠 |
| 模型制作方法 | 包含广泛表达启动子和绿色荧光报告基因的慢病毒载体(FUGW-miR146a)注射到BALB/c小鼠的受精卵中,待小鼠出生后,通过RT-PCR的办法进行筛选,获得高表达miR146a的转基因小鼠。
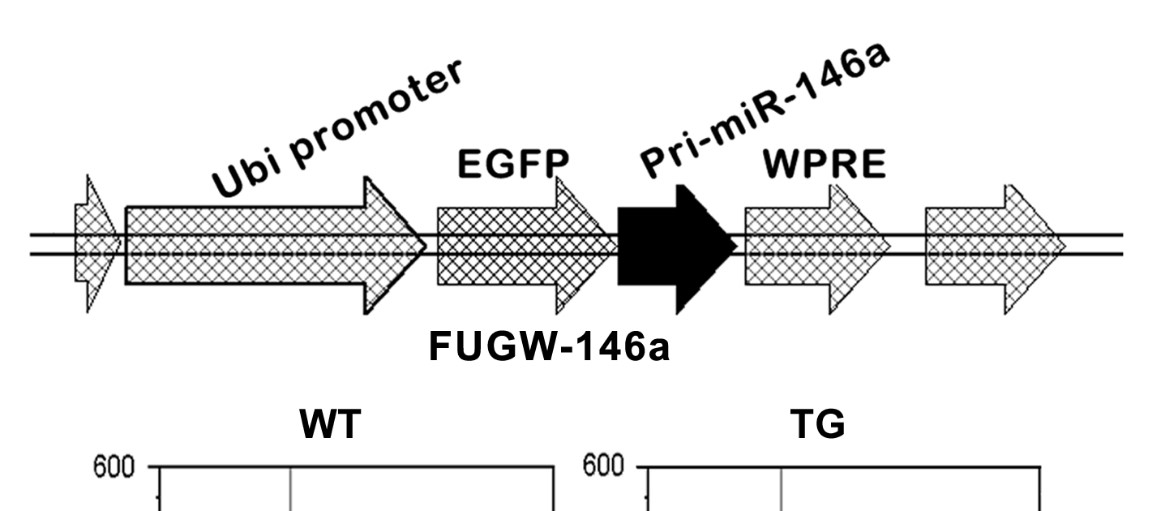 |
| 模型表型数据 | 一、miR-146a Tg小鼠的鉴定 在对miR-146a Tg小鼠进行扩增繁育之前,从引进的4只miR-146a Tg小鼠中选取1只雄性小鼠,取其胸腺、淋巴结(双侧腹股沟、腋窝、臂丛淋巴结)及脾脏,研磨制备成单细胞悬液并裂解红细胞,流式细胞术检测报告基因eGFP的表达水平,剩余细胞Trizol法提取总RNA,real-time定量PCR检测成熟miR-146a的表达水平。结果显示,①在WT小鼠的淋巴结细胞和脾脏细胞中,miR-146a的表达水平远高于胸腺细胞,分别是其26和36倍,这与之前的报道一致。②miR-146a Tg小鼠的胸腺、淋巴结和脾脏细胞eGFP荧光强度较WT小鼠高约1个数量级,成熟miR-146a表达水平大于两倍(图1)。  图1 miR-146a Tg小鼠鉴定
A. 流式细胞术检测miR-146a Tg和WT小鼠胸腺、淋巴结、脾脏细胞中报告基因eGFP的表达水平。B. Real-time PCR检测miR-146a转基因和WT小鼠胸腺、淋巴结、脾脏细胞中成熟miR-146a的表达水平。数据以管家基因U6作为内参进行均一化操作。
二、miR-146a调控γδ T细胞、CD8+ T细胞的胸腺发育 (一)miR-146a Tg小鼠的淋巴结和脾脏肿大,淋巴细胞各个亚群的绝对数量增多。 在解剖小鼠的过程中发现,与WT小鼠相比miR-146a Tg小鼠的次级淋巴器官(淋巴结和脾脏)肿大十分明显(图2 A),这与万瑛教授课题组的研究结果一致。随后,将淋巴结和脾脏研磨,制备成单细胞悬液,进行流式细胞术的检测。结果显示,miR-146aTg小鼠淋巴结中的细胞总数,包括T和B淋巴细胞的绝对数量显著升高,并且T细胞较B细胞更为显著[(1083±124 vs. 374±62)×104,P<0.001]。其中,T细胞各亚群(αβ T细胞,包括CD4+、和CD8+ T细胞以及γδ T细胞)的绝对数量均显著升高(图2 B)。 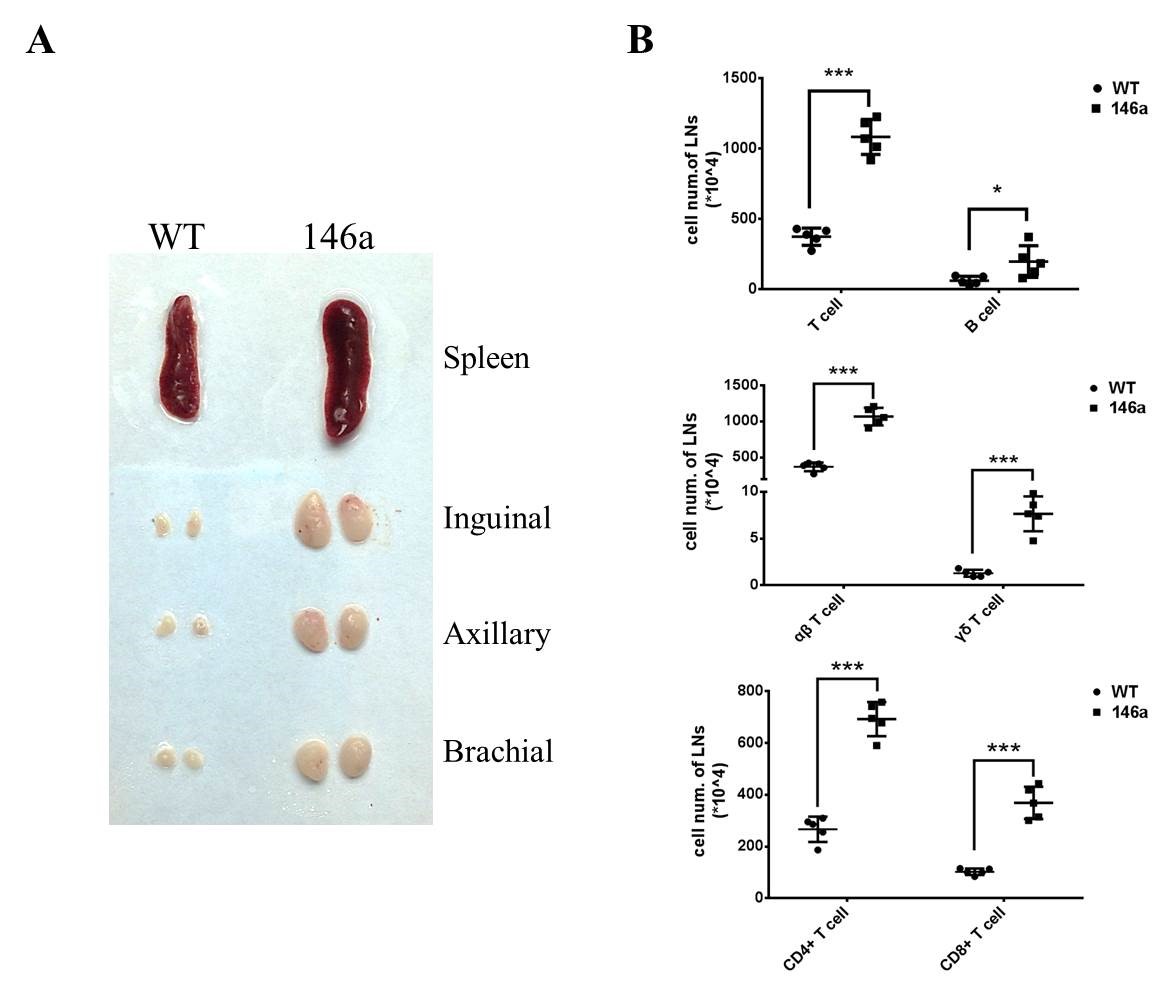 图2 miR-146a转基因小鼠脾脏、淋巴结增生,T、B细胞以及各T细胞亚群的绝对数量增加
A. 脾脏及双侧腹股沟、腋下、臂丛淋巴结取自7周龄、雌性WT小鼠(左)或miR-146a Tg小鼠(右)。脾脏、淋巴结肿大如图所示。B. 应用流式细胞术计数WT及miR-146a Tg小鼠淋巴结中的T、B细胞,CD4+、CD8+ T细胞,αβ、γδ T细胞的绝对数量。每组5只小鼠,7周龄,雌雄不限。B中每点代表一只小鼠,数值代表均数±标准差。统计学差异表示为:* P<0.05,** P<0.01,*** P<0.001(Student T检验)。
(二)T细胞亚群相对数量的改变 除绝对数量增多外,淋巴结和脾脏细胞的流式细胞术检测结果还显示T细胞亚群间的相对比例改变:αβ T细胞亚群比例降低,γδ T细胞亚群比例升高;CD4+ T细胞亚群降低,CD8+ T细胞亚群升高。种变化趋势在淋巴结和脾脏中是一致的(图3)。  图3 miR-146a Tg小鼠淋巴结和脾脏中αβ T细胞和CD4+ T细胞比例降低,γδ T细胞和CD8+ T细胞比例升高 A~D. 流式细胞术检测miR-146a Tg及WT小鼠淋巴结中αβ 、γδ T细胞(A、B),CD4+、CD8+ T细胞(C、D)相对比例。E~H. 流式细胞术检测miR-146a Tg及WT小鼠脾脏中CD4+、CD8+ T细胞(E、F),αβ 、γδ T细胞(G、H)相对比例。流式图随机挑选每组结果中的一次;统计图中每点代表一只小鼠,数值代表均数±标准差。统计学差异表示为:* P<0.05,** P<0.01(Student T检验)。 (三)miR-146a Tg小鼠胸腺中T细胞发育异常
miR-146a Tg小鼠外周淋巴器官中,T细胞绝对数量的增多加以T细胞亚群相对比例的改变提示,或是胸腺中T细胞发育的异常导致外周T细胞绝对数量和相对比例的改变。检测了miR-146a Tg小鼠胸腺中T细胞发育情况。 胸腺中T细胞发育根据CD4和CD8分子的表达情况分为3个阶段:CD4- CD8-双阴性(Double negative,DN)阶段、CD4+ CD8+双阳性阶段、CD4+ CD8-或CD4- CD8+单阳性阶段;其中DN阶段的T细胞又可根据CD25和CD44的表达进一步分为DN1(CD25- CD44+)、DN2(CD25+ CD44+)、DN3(CD25+ CD44-)和DN4(CD25- CD44-)4个亚阶段。流式细胞术的结果显示:①miR-146a转基因动物的CD8+ SP T细胞相对比例降低,而处于其他发育阶段阶段的T细胞没有显著变化;②miR-146a Tg小鼠胸腺中γδ T细胞的比例降低(图4),这证实了上文中提出的假设,但值得注意的是其变化趋势与淋巴结、脾脏相反。 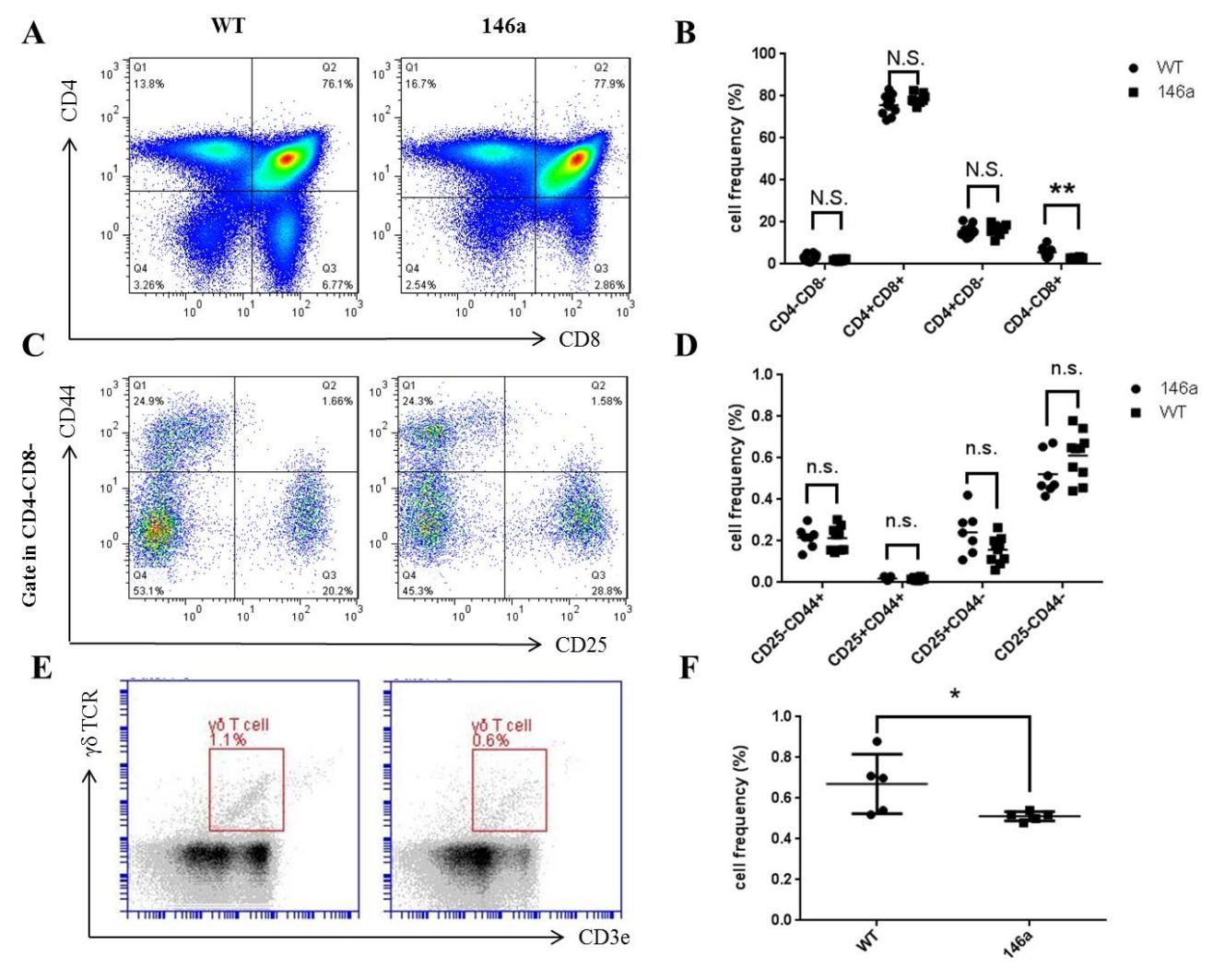 图4 miR-146a Tg小鼠胸腺中γδ T细胞、CD8+ T细胞比例降低
A~D. 流式细胞术检测miR-146a Tg及WT小鼠胸腺中DN、DP、SP (A、B)以及DN中DN1~4 (C、D)T细胞比例。E、F. 流式细胞术检测miR-146a Tg及WT小鼠胸腺中γδ T细胞相对比例。每组5到10只小鼠(7周龄,雌雄不限)。流式图随机挑选每组结果中的一次;统计图中每点代表一只小鼠,横线数值代表均数±标准差。统计学差异表示为:N.S. P>0.05,** P<0.01,*** P<0.001(Student T检验)
三、miR-146a影响小肠上皮内淋巴细胞构成与功能,导致小鼠对DSS诱导的肠炎易感性增加 除了淋巴结、脾脏肿大外,在解剖miR-146a Tg小鼠的过程中还发现有10%到15%的动物其小肠肠壁有充血的现象,有的小鼠还有伴有腹泻。这些现象与肠炎症状类似。提示,系统性过表达miR-146a使小鼠易感肠炎。随后,采用一种广泛应用的肠炎模型——DSS诱导的肠炎模型,从整体水平研究miR-146a与肠炎的关系。 (一)系统性过表达miR-146a加重小鼠DSS诱导的肠炎 用3% DSS水溶液替换小鼠的日常饮水,让其自由饮用10天,诱导miR-146a Tg及WT小鼠产生肠炎。相比与WT小鼠,miR-146a Tg小鼠表现出更加严重的肠炎症状(图5),表现为:①较早出现腹泻、血便等症状;②体重下降较快;③较低的存活率。病理学检查同样发现,miR-146a Tg小鼠结肠末端充血或变薄,肠道中未见成型粪便;镜下结肠组织呈明显的坏死,结肠绒毛缺失,黏膜下层变薄或缺失,浆膜层变薄。上述结果说明,系统性过表达miR-146a会加重DSS诱导肠炎的症状及组织损伤程度。 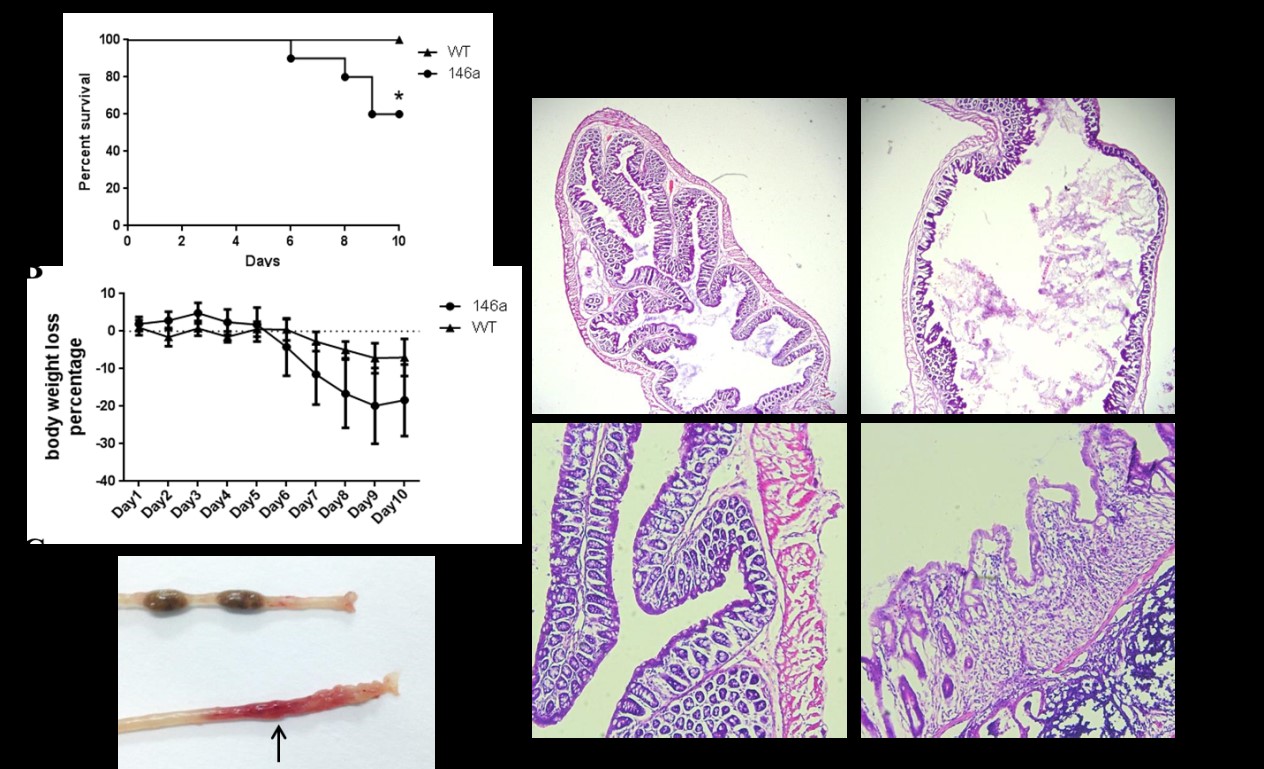 图5 系统性过表达miR-146a加重DSS诱导的肠炎
miR-146a Tg小鼠及WT小鼠各10只(雌、雄各5只),用3% DSS水溶液替换其饮水,让小鼠自行饮用5天(C)或10天(A、B、D),每日观察小鼠生存状态并称量体重。A. miR-146a Tg及WT小鼠的生存曲线。B. miR-146a Tg及WT小鼠的体重降低百分数曲线。C. DSS诱导5天后,miR-146a Tg小鼠结肠末端肠壁充血(箭头所示)。D. DSS诱导10天后,H&E染色显示miR-146a Tg与WT小鼠结肠组织的病理改变。第一排为25倍视野,第二排为100倍视野。
(二)miR-146a Tg小鼠小肠IELs中γδ T细胞比例升高,并以Vγ1亚群为主 在胃肠道黏膜表面有大量散在分布的IEL,它们直接与外界环境接触,构成了抵御胃肠道感染的“第一道防线”,与肠道微环境的稳态及肠道炎症密切相关。IEL的细胞组成十分特别,它主要由80%以上的T细胞、少量B细胞或其他细胞构成,其中的T细胞又不同于外周淋巴组织(以αβ T细胞为主),γδ T细胞占了很大比例(图6)。 由于IEL中γδ T细胞在肠炎中的重要作用,应用流式细胞术对小肠IEL的组成进行了分析,发现miR-146a Tg小鼠小肠IEL中γδ T细胞比例升高,并主要以Vγ1亚群为主(图6)。 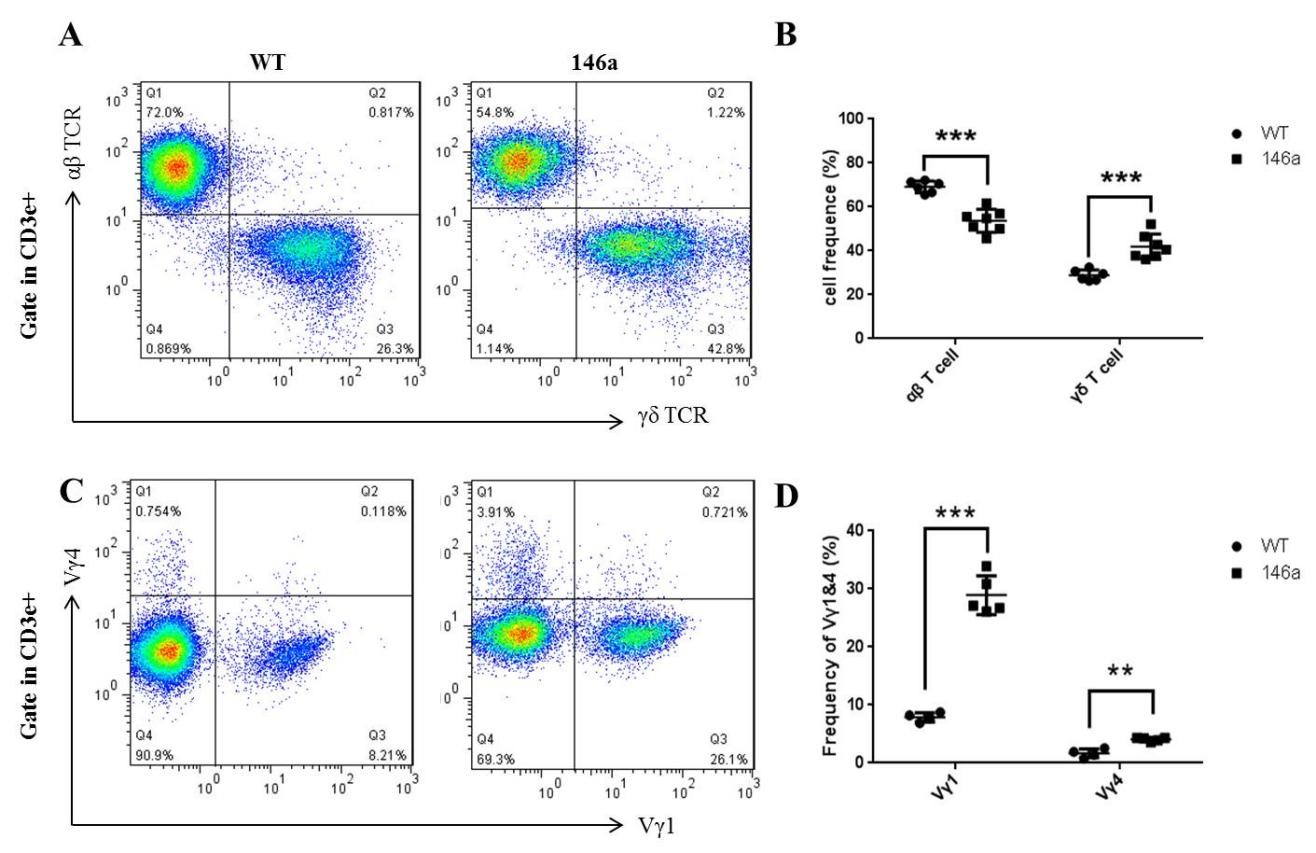 图6 miR-146a Tg小鼠小肠上皮内淋巴细胞中γδ T细胞比例升高,尤其是Vγ1亚群 小肠IELs分离自7周龄的miR-146a Tg(n=8)或WT(n=6)小鼠(雌雄不限),流式细胞术检测其中αβ T细胞、γδ T细胞(A、B)及其Vγ1、Vγ4亚群(C、D)比例。流式图随机挑选每组结果中的一次。统计图中每点代表一只小鼠,横线数值代表均数±标准差。统计学差异表示为:*** P<0.001(Student T检验)。
(三)miR-146a Tg小鼠小肠IEL分泌较多的 IL-6、IL-1β和IL-17A 接下来检测了miR-146a Tg小鼠小肠IEL细胞因子的分泌功能。首先,分离miR-146a Tg和WT小鼠小肠IEL,用固相化的抗CD3抗体(1 μg/mL)联合抗CD28抗体(1 μg/mL)刺激培养,在体外活化6h或24h后收集培养基上清,ELISA检测其中促炎性细胞因子IL-17A、IL-1β、IL-6、TNF-α,以及IFN-γ的含量。结果显示,与WT小鼠相比,Tg小鼠小肠IEL促炎性细胞IL-1β、IL-6 和IL-17A分泌量升高;而INF-γ的分泌量不受影响(图7)。 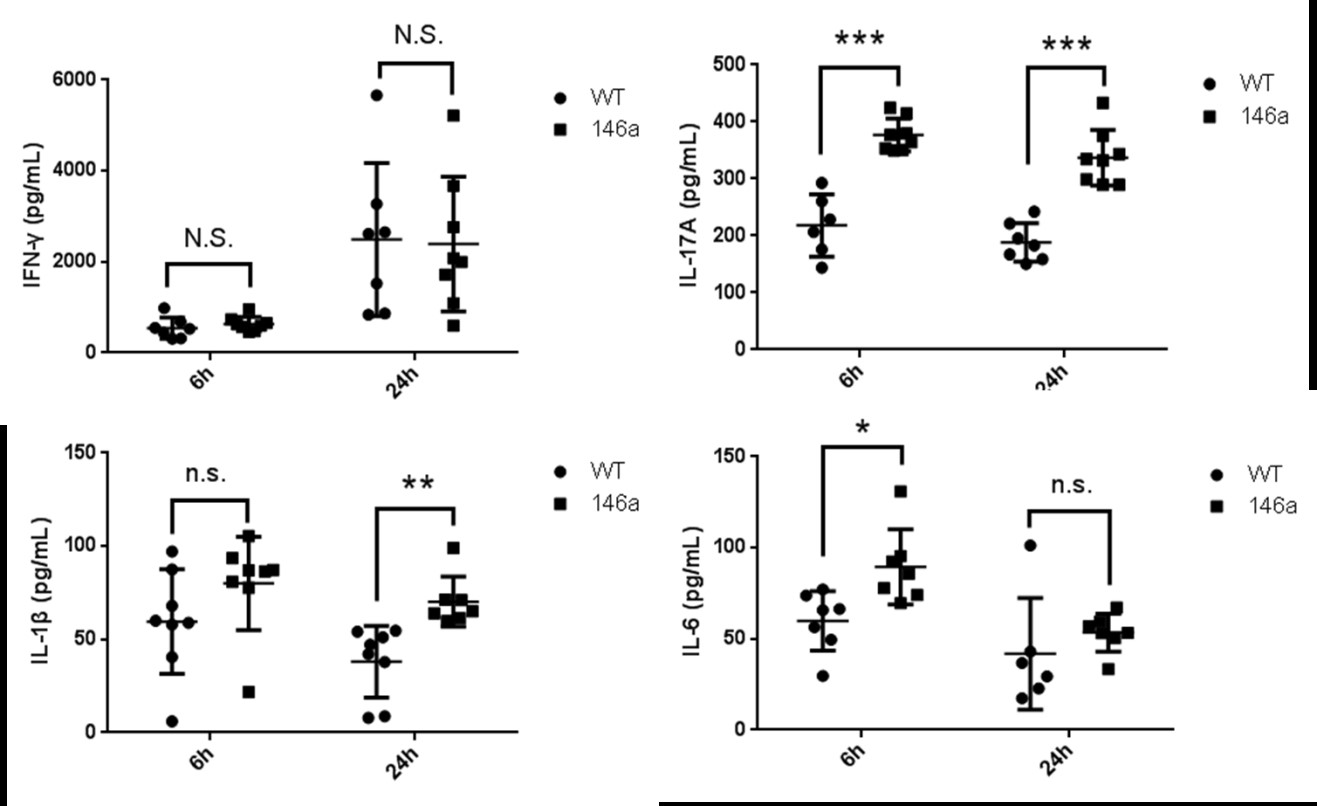 图7 miR-146a Tg小鼠小肠IEL分泌较多的IL-17A、IL-1β和IL-6 小肠IEL分离自7周龄大miR-146a Tg和WT小鼠(雌雄不限),经固相化的抗CD3e抗体(1 μg/mL)联合抗CD28 抗体(1 μg/mL)刺激6h、24h后,收集培养基上清,ELISA检测其中细胞因子含量。统计图中每点代表一只小鼠,数值代表均数±标准差。统计学差异表示为:N.S. P>0.05,* P<0.05,** P<0.01,*** P<0.001(Student T检验)。
|
| 动物模型的评价与验证 | 1动物模型基因型鉴定 146a-upGCTCTAGAGGGTCAAGTACAAGTAAGC 146a-downCGGGATCCTGAGGAGGTGATTCAGTAG。 2 WB评价该基因在过表达和条件小鼠的蛋白表达水平 提取小鼠各组织器官和前脑进行免疫印迹和免疫组化,确认TSPO在各器官的表达情况。 3 TSPO Tg/cTg小鼠表型 TSPO过表达小鼠出现发育迟缓和早期死亡。 TSPO过表达引起小鼠小胶质细胞线粒体的碎片化,以及线粒体分裂相关蛋白 MFN1,MFN2 的比例失衡。 TSPO过表达引起神经炎症状态下小鼠脑组织小胶质细胞增殖和ASC斑点释放,导致脑组织内促炎细胞因子水平上调,加重神经炎症水平。示TSPO可能在炎症激活通路中起到负调控作用。 |
| 保存方式 | 活体 |
| 合作方式 | 不限定 |
| 相关文章 | Li Z, Zhang S, Wan Y, Cai M, Wang W, Zhu Y, Li Z, Hu Y, Wang H, Chen H, Cui L, Zhang X, Zhang J*, He W*. MicroRNA-146a Overexpression Impairs the Positive Selection During T Cell Development. Front Immunol. 2018 Jan 23;8:2006. doi: 10.3389/fimmu.2017.02006. PMID: 29410664; PMCID: PMC5787067. |
| 备注 |


 京公网安备 11010502043083号
京公网安备 11010502043083号