| 标识符 | CSTR:16397.09.0C01001456 | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 资源中文名称 | BCG疫苗安全性评价及免疫原性评价的动物模型 | ||||||||||||||||
| 资源英文名称 | Animal models for safety and immunogenicity evaluation of BCG vaccines | ||||||||||||||||
| 疾病概述 | 结核病是全球公共卫生面临的重大挑战之一,根据世界卫生组织(WHO)发布的《2023年全球结核病报告》,结核病是仅次于COVID-19的第二大致死性传染病。在30个结核病高负担国家中我国估算结核病发病数排第3位。全球结核病发病率下降趋势发生逆转,防治形势十分严峻。而与此同时,耐药结核病日趋严重。 控制这一全球流行病的最有效手段是预防性免疫,因此疫苗的研发急不可待。目前唯一获得批准使用的结核疫苗还是100年前发明的卡介苗BCG,但是卡介苗保护效果差强人意,对成年人保护效果弱。因此,为实现WHO提出的“终结结核病流行”目标,研发新型结核疫苗至关重要。 人类感染结核是一个复杂的过程,所有候选疫苗进入临床试验前必须评价其安全性、免疫原性以及有效性。候选结核疫苗的评价模型常使用的动物包括小鼠、豚鼠以及非人类灵长类动物等。然而疫苗效果的评估具有复杂性和不确定性,随着开发新的、更有效的结核病疫苗工作的开展,改进疫苗评估的临床前动物模型的建立具有十分重要的意义。 | ||||||||||||||||
| 实验动物背景信息 | SCID(Server Combined Immune-Deficiency,重度联合免疫缺陷)小鼠 C57BL/6小鼠 |
||||||||||||||||
| 模型制作方法 | 1. 实验材料 1.1 实验动物 SCID和C57BL/6小鼠购自北京维通利华实验动物技术有限公司 1.2 主要实验仪器 BIO-RAD电泳仪 Thermo Fisher Scientific 紫外-可见分光光度计 Innova44 恒温摇床 BD LSRFortssa 流式细胞仪 Eppendorf 离心机 Eppendorf 移液器 2. 实验操作规程和动物处理伦理 模型制作中涉及动物的操作程序已获得首都医科大学附属北京胸科医院实验动物伦理委员会的批准,批准号为XK2023-117,简要步骤如下: 2.1 BCG候选疫苗免疫接种 将SPF级6‐8周龄雌性SCID小鼠(质量16‐20 g)随机分为5组,每组5只。免疫剂量为1×106/1×107 CFU,免疫方式为尾静脉接种,免疫周期为1针,总时长42天。 将SPF级6‐8周龄雌性C57BL/6小鼠(质量16‐20 g)随机分为5组,每组5只。免疫剂量为1×106 CFU,免疫方式为皮下免疫,免疫周期为1针,总时长60天。 2.2 标本的收集 动物安乐死后摘眼球取血,解剖取肺、脾组织样本。肺组织用剪刀剪碎,加胶原酶在37摄氏度摇床中消化20-30 min。用筛网过滤后加PBS洗一遍,离心后加红细胞裂解液处理5 min,若细胞沉淀仍有红色,可再裂解一次。加PBS重悬细胞,计数。将脾组织倒在筛网上,用注射器的尾部研磨,加PBS冲洗筛网,离心后加红细胞裂解液处理5 min,加PBS重悬细胞,计数。 2.3小鼠肺脏、脾脏内菌落计数 小鼠处死后在无菌的条件下取部分肺脏和脾脏用于组织病理学观察。对剩余的肺脏和脾脏用研磨器研磨后,用无菌的生理盐水分别按照1:10,1:100,1:1000,1:10000,1:100000五个梯度进行稀释,每份稀释液涂布两块7H10平板,涂布完毕后将平板包好装袋,置于37°C培养箱培养3-4周至长处肉眼可见的清晰菌落。观察结果,选择合适的浓度梯度(菌落数在30-300个之间)进行计数。 2.4 流式细胞分析 用不同的荧光抗体标记细胞,通过流式细胞仪分析细胞的亚型分群。肺取10^6,脾取10^7个细胞,离心后用100ul PBS重悬。准备流式管,包括每个样品管和一个空白管,每个抗体的单染管和一个调电压的管。空白管,单染管和调电压的管加100ul 其中一个样本脾的细胞,其他按样品各加100ul。空白管不加抗体,单染管加5ul相应单个抗体,调电压的管和所有样品管加5ul所有抗体的混合液,4℃孵育30min,离心, 加1ml PBS重悬后离心洗一次,加2%的多聚甲醛固定后加到流式管中,上机检测。 2.5 血清细胞因子检测 样品从-80℃取出放冰上融化。按照Bio-Plex Pro Mouse Cytokine 23-plex Assay试剂盒protocol操作。 |
||||||||||||||||
| 模型表型数据 | 1.BCG疫苗安全性评价动物模型的建立 本实验使用SCID小鼠用于疫苗安全性评价,C57BL/6小鼠用于免疫原性评价。通过检测T细胞的相关作用可以反映细胞免疫原性;通过检测总抗体反应、中和抗体水平及血清抗体分型反映体液免疫原性。SCID(severe combined immunodeficient,严重联合免疫缺陷)小鼠通常用于评估活疫苗的安全性。BCG疫苗候选株尾静脉接种SCID小鼠,每周监测动物体重和疾病迹象。接种后42天,分析小鼠脾脏和肺部疫苗清除率(图1)。
1.1 体重和疾病现象
在低剂量(106)接种时,对照组和几组实验组小鼠体重在42天内体重持续上升,正常增长,没有明显区别;而当接种高剂量(107)时,接种野生型BCG的小鼠体重基本维持不变;接种BCG::RD1的动物出现了最严重的临床症状,其中3只小鼠在最后一周发生死亡,并且该组小鼠体重减轻幅度最大;接种M1::RD1和M2::RD1两种重组BCG疫苗的小鼠体重增长曲线介于对照组和BCG组之间(图2)。 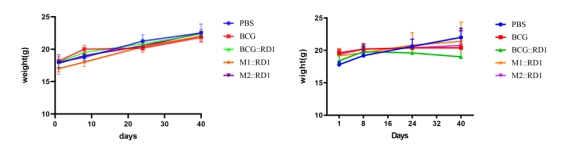 图2. SCID小鼠体重变化 A. 106 CFU B.107 CFU 1.2 脾、肺荷菌量
疫苗接种6周后导致脾组织中CFU数量相比肺中更高,表明尾静脉递送可能允许分枝杆菌的广泛传播。接种野生型BCG的组6周后从小鼠脾脏组织分离出约107CFU的菌;接种BCG::RD1的小鼠疫苗清除率最低,菌落数量约为野生组的10倍;接种M1::RD1和M2::RD1的小鼠菌落数量介于二者之间,而在肺部组织中,接种M1::RD1组小鼠菌落数量最多。计数脾肺组织中细菌的含量也可以看出在低剂量接种时不同疫苗候选株差异不明显,高剂量时差异更加明显。这些结果说明了107是评价这些疫苗候选株安全性比较合适的剂量(图3)。 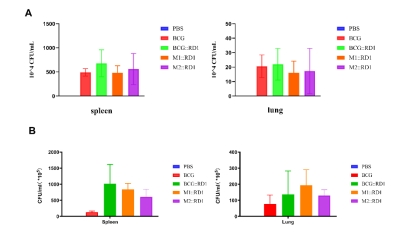 图3. BCG疫苗候选株接种SCID小鼠脾、肺荷菌量。A. 106 CFU B.107 CFU 2. BCG疫苗免疫原性检测动物模型的建立 免疫原性是评价疫苗有效性的重要指标之一。通过检测T细胞的相关作用可以反映细胞免疫原性;通过检测总抗体反应、中和抗体水平及血清抗体分型反映体液免疫原性。1*106 CFU BCG疫苗候选株皮下接种C57BL/6小鼠,60天后检测免疫原性(图4)。
图4. BCG疫苗株安全性检测示意图 2.1 细胞免疫功能评价 对于细胞免疫功能评价,检测抗原特异性T细胞反应及相关的细胞因子等。包括特异性T细胞:CD4+、CD8+、Th1、Th2、Th17、Treg细胞亚群;以及T细胞免疫相关的细胞因子:IL-2、IL-4、IL-5、IL-6、IFN-γ、TNF-α等的释放水平。 2.1.1使用流式细胞术通过检测细胞表面marker来检测不同T细胞亚群,为此我们建立了一个8通道荧光配色方案,如下表1:
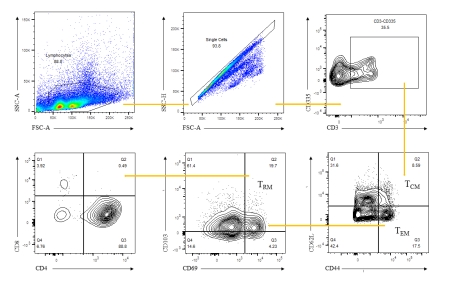
表1.荧光配色方案 根据这8种细胞表面marker,可对不同亚群的T细胞进行分类,圈门逻辑如下(图5):
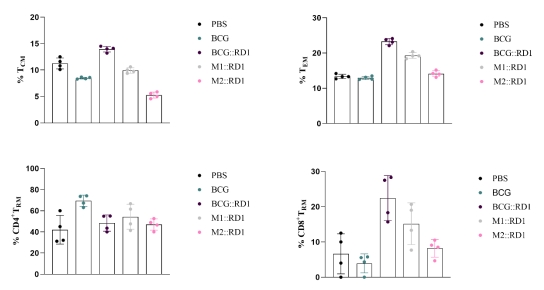
图5. T细胞分类 大多数结核病疫苗诱导记忆性T细胞,可分为早期TEM反应和长期TCM反应。TCM是中央记忆型T细胞(Central Memory T cell)在防御结核分枝杆菌的再感染和再激活方面发挥着重要作用。TEM是效应记忆型T细胞(Effector memory T cell),是被激活的TCM细胞;组织驻留记忆T细胞 (Resident memory T cell)是一种新近被发现的T细胞亚群,被认为在防御空气传播感染方面发挥着重要作用。 接种BCG::RD1的小鼠表现出明显高水平的TCM TEM和CD8+TRM,而BCG、M1::RD1和M2::RD1三组小鼠相比于不接种疫苗的对照组没有太大区别(图6)。
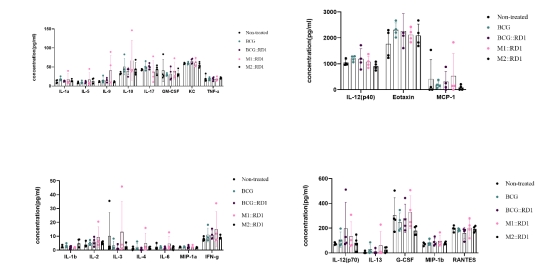
图6.细胞因子检测 2.1.2 利用多重细胞因子检测技术检测免疫后小鼠血液样本中23种细胞因子和趋化因子含量变化 Bio-Plex Pro Mouse Cytokine Standard 23-Plex Kit基于小鼠细胞因子和趋化因子磁性微球检测试剂可检测定量来自多种基质(如血清、血浆和组织培养物上清液)中23种分析物的水平。结核特异性抗原刺激后,会产生特异性的细胞因子,如与Mtb感染的有效控制相关的TH1效应反应细胞因子(IFN-γ, IL-2和IL-12p70),其他细胞因子如IL-1β、IL-6和TNF-α等是象征全身性炎症的标志物。 与未接种疫苗的对照组相比,接种BCG和BCG::RD1、M1::RD1、M2::RD1的组小鼠血液中IL-1β、IL-6和TNF-α等象征全身炎症的标志物水平均未明显增加,而与Mtb感染的有效控制相关的TH1效应反应细胞因子(IFN-γ, IL-2和IL-12p70)水平均有轻微升高(图7)。
图7.细胞因子和趋化因子检测 2.2 体液免疫功能评价 收集免疫小鼠的血清样品用于通过ELISA评估抗体滴度。我们使用ProcartaPlex Mouse Antibody Isotyping Panel 2 7-Plex Kit分析7种蛋白靶标来测定抗体重链亚类:IgA、IgE、IgG1、IgG2b、IgG2c、IgG3和IgM。 IgA与增强对结核分枝杆菌的保护作用有关,IgG2a/ IgG1的高比值表明免疫反应以Th1样为主。 |
||||||||||||||||
| 动物模型的评价与验证 | 1. BCG疫苗安全性和免疫原性评价动物模型的建立 候选结核疫苗的评价模型常使用的动物包括小鼠、豚鼠以及非人类灵长类(non-human primates,NHP)动物等。小鼠因其低成本、大样本数据易获得以及易于标准化实践操作等优点,已成为疫苗评价中最普遍使用的初筛动物模型,常采用C57BL/6、BALB/C以及C3HeB/FeJ等品系。本实验使用SCID小鼠用于疫苗安全性评价,C57BL/6小鼠用于免疫原性评价。 2. BCG候选疫苗安全性评价 当采用10^6低剂量接种时不同疫苗候选株表型差异不明显,包括小鼠体重变化(图2)、疾病发生现象和脾、肺组织的荷菌量(图3)。而高剂量接种时这些指标的差异更加明显,说明了10^7是评价这些疫苗候选株安全性比较合适的剂量。 3. T细胞分群情况 大多数结核病疫苗诱导记忆性T细胞,在防御结核分枝杆菌的再感染和再激活方面发挥着重要作用。通过流式细胞术检测T细胞表面不同的CD分子可以区分不同T细胞亚群。接种BCG::RD1的小鼠表现出明显高水平的TCM 、TEM和CD8+TRM,而BCG、M1::RD1和M2::RD1三组小鼠相比于不接种疫苗的对照组没有太大区别(图6)。 4.血清细胞因子含量变化 结核特异性抗原刺激后,会产生特异性的细胞因子。与未接种疫苗的对照组相比,接种BCG和BCG::RD1、M1::RD1、M2::RD1的组小鼠血液中IL-1β、IL-6和TNF-α等象征全身炎症的标志物水平均未明显增加,而与Mtb感染的有效控制相关的TH1效应反应细胞因子(IFN-γ, IL-2和IL-12p70)水平均有轻微升高(图7)。 |
||||||||||||||||
| 保存方式 | |||||||||||||||||
| 合作方式 | |||||||||||||||||
| 相关文章 | |||||||||||||||||
| 备注 |




 京公网安备 11010502043083号
京公网安备 11010502043083号