| 标识符 | CSTR:16397.09.0B01001450 |
|---|---|
| 资源中文名称 | 肠上皮NSD2条件性敲除小鼠结直肠癌模型 |
| 资源英文名称 | NSD2 flox/flox, Vil1-Cre Mouse Model |
| 疾病概述 | 结直肠癌是一种常见的异质性肿瘤,在所有恶性肿瘤中发病率位居第四,死亡率位居第二。结直肠癌的早期症状不明显,患者随着肿瘤的逐渐增大而表现出排便习惯改变、便血、腹泻、腹泻与便秘交替、局部腹痛等症状;晚期则表现出贫血、体重减轻等全身症状。当前,结直肠癌对许多患者来说仍然是致命的,深入了解结直肠癌发生发展的病理机制对于该疾病的早期诊断和治疗至关重要。 |
| 实验动物背景信息 | 1. 基因信息
Nsd2:nuclear receptor binding SET domain protein 2 [ Mus musculus (house mouse) ] Gene ID: 107823 Primary source:MGI:MGI:1276574 Ensembl:ENSMUSG00000057406 AllianceGenome:MGI:1276574 Gene type:protein coding RefSeq status:VALIDATED Organism:Mus musculus Also known as: MMSET; Whsc1; Whsc1l; mKIAA1090; 5830445G22Rik; 9430010A17Rik; C130020C13Rik; D030027O06Rik; D930023B08Rik. 2. 实验动物背景信息
C57BL/6J小鼠 3. 研究背景
NSD2(nuclear receptor SET domain-containing 2)也被称为MMSET(multiple myeloma SET domain)或WHSC1(Wolf-Hirschhorn syndrome candidate 1),是NSD蛋白家族的一员, NSD家族作为甲基转移酶识别并催化组蛋白甲基化。NSD2在多种人实体瘤中过表达,包括肺癌、前列腺癌、乳腺癌、肝癌、头颈鳞癌、骨肉瘤等等。大量研究表明,NSD2与多种可能导致肿瘤发生的细胞过程有关。 基因表达谱交互分析(Gene Expression Profiling Interactive Analysis,GEPIA, http://gepia.cancer-pku.cn/)数据库显示,结肠癌和直肠癌组织中NSD2 mRNA水平显著高于正常组织。表明NSD2在结直肠癌的发生发展中可能起关键作用。本研究中,我们建立了肠上皮细胞条件性敲除NSD2的小鼠模型,并采用AOM/DSS处理诱导小鼠结直肠癌。AOM/DSS模型是一种高效、可重复且相对经济的结肠炎相关癌症模型构建方法,该方法诱导的自发性结直肠癌能够更真实地模拟人类肿瘤的发生发展过程,被认为是结肠炎相关癌症的精确模型。 |
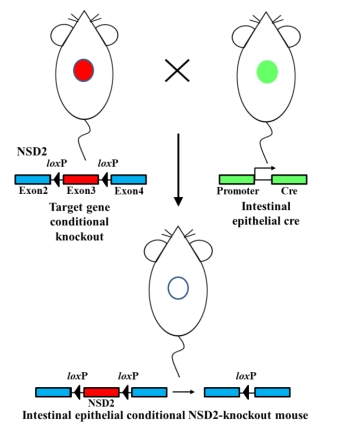
| 模型制作方法 | 1.小鼠的构建
NSD2-floxp(NSD2fl/fl)小鼠与Vil1-Cre小鼠由北京唯尚立德生物科技有限公司构建完成。根据NSD2基因组结构和蛋白功能保守区,NSD2存在多种转录产物,其中exon3为公共的外显子,位于蛋白保守功能区Msh6_like上,编码167 bp碱基数。因此条件性删除exon3后,可能会破坏蛋白保守功能区Msh6_like,使mRNA重新剪切形成新的mRNA,发生移码突变,导致蛋白失活。因此选取exon3两边插入floxP位点,实现将exon3条件性敲除,达到条件性敲除目标基因的目的。 利用CRISPR技术剪切目标基因内含子的DNA,同时提供同源模板Donor, 通过DNA的同源重组修复在特定外显子两端插入floxp。NSD2fl/fl小鼠与组织特异性表达Cre的Vil1-Cre小鼠交配,使得NSD2特定外显子被删除,NSD2将不翻译或者发生移码突变,引起蛋白失活,从而实现肠上皮细胞条件性敲除NSD2的目的。
图1 NSD2fl/fl-Vil1-Cre小鼠的构建 2.结直肠癌模型的构建
实验第1天,每只小鼠按12 mg/kg腹腔注射溶于生理盐水的结肠嗜器官致癌物偶氮甲烷(azoxymethane,AOM;A5486, Sigma),化学诱导小鼠结直肠癌。正常饲养小鼠5天后,将2.5%的右旋葡聚糖硫酸钠(dextran sodium sulfate,DSS;9011-18-1, Merck) 溶解在动物饮用水中,连续5天诱导小鼠结肠炎。随后,提供两周的正常饮水。接下来,重复进行两轮2.5% DSS诱导(第25-29天和第44-48天)。最后,在第90天对终止实验,处死小鼠进行样本分析。 |
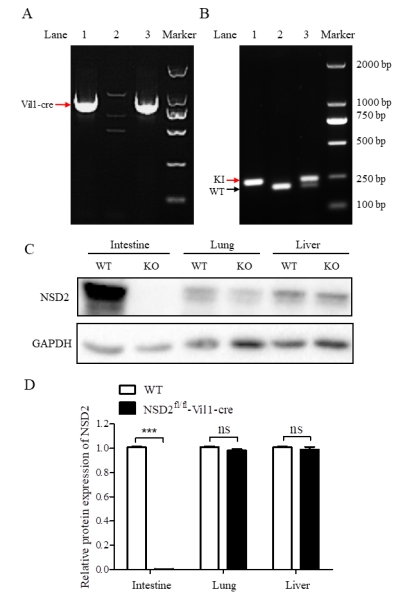
| 模型表型数据 | 在无特殊刺激的情况下,NSD2fl/fl-Vil1-Cre小鼠没有明显表型,且外观与C57BL/6J野生型(wild type,WT)小鼠无明显差异。 (一)小鼠基因型与蛋白表达鉴定结果 如图1(A)所示,Vil1-Cre阳性小鼠条带在921 bp,Vil1-Cre阴性小鼠无条带。如图1(B)所示,WT小鼠条带大小在209 bp,NSD2fl/fl纯合小鼠条带在243 bp, NSD2fl/+杂合小鼠条带在209 bp和243 bp。如图1(C-D)所示,NSD2fl/fl-Vil1-Cre小鼠肠组织中NSD2被敲除,但在肺、肝等其他组织中仍有表达。
注:(A)1、3:Vil1-Cre阳性小鼠;2:WT小鼠;(B)1:NSD2fl/fl纯合小鼠,2:WT小鼠;3:NSD2fl/fl杂合小鼠;(C-D)WT和NSD2fl/fl-Vil1-Cre小鼠组织中NSD2的表达水平。n=3, ***P < 0.001。 图1 小鼠基因型与蛋白表达鉴定结果 (二)小鼠主要脏器HE染色 小鼠主要脏器的HE染色结果显示,与 WT小鼠比较,NSD2fl/fl-Vil1-Cre小鼠的主要脏器表型未见明显差异。
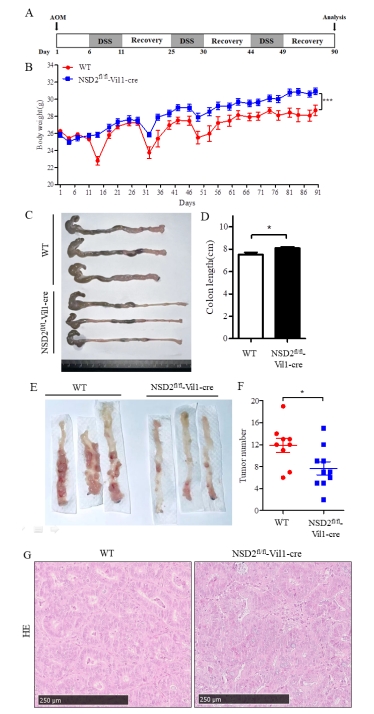
注:WT和NSD2fl/fl-Vil1-Cre小鼠相比无显著差异。 图2 WT和NSD2fl/fl-Vil1-Cre小鼠主要脏器HE染色 (三)结直肠癌模型构建 图3A为实验的时间流程。第1天,所有小鼠腹腔注射AOM;随后,分别于第6-11天、第25-29天和第44-48天给予2.5% DSS饮水进行三轮诱导;最后给予正常饮水恢复至第90天。与WT小鼠相比,NSD2fl/fl-Vil1-Cre小鼠在实验过程中体重呈明显上升趋势(图3B)。此外,NSD2fl/fl-Vil1-Cre小鼠表现出较轻的结肠炎症状,包括未成形的粪便、直肠出血和结肠长度缩短(图3C-D)。在NSD2fl/fl-Vil1-Cre小鼠中,结直肠肿瘤数量明显减少(图3E-F)。两组小鼠的结直肠肿瘤组织HE染色如图3G所示。
注: (A) WT和NSD2fl/fl-Vil1-Cre小鼠在第1天腹腔注射AOM,然后分别于第6-11天、第25-29天和第44-48天给予含2.5% DSS的饮水,最后恢复正常饮水直至第90天。(B)每3天测量小鼠的体重变化,直至第90天。(C-D)在第90天测量结直肠长度。(E-F)第90天结直肠组织中的肿瘤数量。(G)结直肠肿瘤组织HE染色。WT (n=9), NSD2fl/fl-Vil1-Cre (n=10),*P < 0.05, ***P < 0.001。 图3 WT和NSD2fl/fl-Vil1-Cre小鼠结直肠癌模型的构建与对比分析 |
| 动物模型的评价与验证 | (一)动物模型评价 NSD2fl/fl-Vil1-Cre小鼠外观表现与WT C57BL/6J小鼠无明显差异,生理条件无异常表型;从肠组织中检测无NSD2表达,而在其他组织中能够检测到NSD2正常表达。 1、DNA鉴定 剪取出生6~7天以内的小鼠尾尖,采用全式金DNA提取试剂盒提取尾部总DNA,进行PCR扩增后,通过琼脂糖凝胶电泳鉴定小鼠DNA是否发生片段删除且为纯合子。 2、蛋白表达鉴定 分别提取小鼠主要器官组织总蛋白,采用赛默飞蛋白定量试剂盒进行定量后通过Western blot鉴定小鼠各组织中是否只有肠组织中无NSD2表达。 (二)评价指标验证 NSD2fl/fl-Vil1-Cre小鼠为肠道上皮特异性敲除NSD2的动物,从小鼠肠组织中不应检测到NSD2表达。 AOM/DSS结直肠癌模型小鼠体重比正常健康小鼠减轻,且在实验终止时解剖可见结直肠中数量不等的肿瘤。通过WT与NSD2fl/fl-Vil1-Cre小鼠AOM/DSS模型各项数据的对比分析,显示特异性敲除肠上皮NSD2抑制了小鼠结直肠癌的发展。 |
| 保存方式 | 活体 |
| 合作方式 | 不限定 |
| 相关文章 | Mengyuan Li,Hanxue Chen,Xingjiu Yang,Wenlong Zhang,Chengyan MA,Qinghong WANG,Xinpei WANG,Ran Gao . Conditional Knockout of NSD2 Gene in Mouse Intestinal Epithelial Cells Inhibit Colorectal Cancer Progression. Animal Models and Experimental Medicine. 2024,1,16 已接收 |
| 备注 |



 京公网安备 11010502043083号
京公网安备 11010502043083号