| 标识符 | CSTR:16397.09.0L02001101 |
|---|---|
| 资源中文名称 | C1ql3基因敲除大鼠模型 |
| 资源英文名称 | Wistar.C1ql3(tm)- GC/ILAS |
| 疾病概述 | 痴呆症(dementia)患者在过去 10 年间从 2400 万增加到 4700 万,预测至2050 年全球痴呆患者将达到 1 亿 3 千万。阿尔茨海默病(Alzheimer's disease, AD)是痴呆症中最常见的类型。在 65 岁以上的老年人群中 AD 患病率达到5.56%,预测到 2050 年我国 AD 患者将达 3000 万。 AD 主要的病理特征包括由淀粉样蛋白(amyloid-beta, Aβ)沉积导致的胞外老年斑(senile plaques, SPs)聚集、胞内神经纤维缠结(intracellular neurofibrillary tangle)、胶质细胞应答(glia responses)、神经元丢失(neuronal loss)和突触丢失(synaptic loss)等。小胶质细胞在Aβ清除和AD病理发展进程中扮演重要角色。 |
| 实验动物背景信息 | Wistar大鼠 |
| 模型制作方法 | 利用CRISPR/Cas9技术建立C1ql3敲除大鼠。靶向C1ql3第一外显子设计两个sgRNAs,序列分别为TCATCCTCATCCCGGTGCTGG和AAGGTGCTGACAAGAGGGAGG。Cas9 蛋白 (30 ng/μL) 和两个sgRNAs (10 ng/μL)显微注射进入受精卵的胞浆,移植进入假孕母鼠。出生的小仔进行基因型鉴定。 |
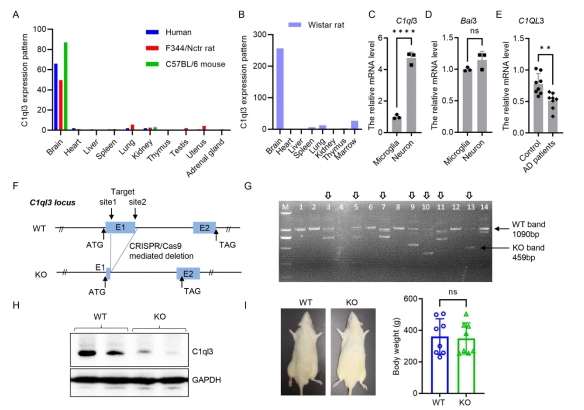
| 模型表型数据 | 1. C1QL3蛋白表达和敲除大鼠的鉴定
首先,Expression Atlas(https://asia.ensembl.org)中收集的数据显示C1ql3在人、F344大鼠和C57BL/6小鼠的脑组织中高表达(图1A)。qRT-PCR结果显示,C1ql3也主要在Wistar大鼠的脑组织中表达(图1B)。其次,在原代培养中,小胶质细胞和神经元都表达C1ql3及其受体基因Bai3(图1C、D)。第三,我们检测了一些阿尔茨海默病患者大脑样本中C1ql3的表达,结果显示,与正常大脑样本相比,AD患者大脑样本中的C1ql3mRNA水平显著降低(图1E)。这些结果表明,C1ql3主要在大脑中表达且由神经元和小胶质细胞产生,其表达降低可能参与AD发展进程。 通过CRISPR/cas9策略产生C1ql3 敲除 Wistar大鼠,从14个子代中获得7个杂合敲除首建鼠(3、5、7、9、10、11、13)(图1F、G)。选择杂合的首建鼠9号和13号进行繁殖,首建鼠13号可以成功传代并产生纯合的KO大鼠。该首建鼠基因组缺失631bp的片段并导致开放阅读框的+61bp处产生终止密码子,因此导致敲除大鼠脑组织中C1ql3蛋白的表达缺陷(图1H)。与WT大鼠相比,KO大鼠的喂养、外观和体重没有明显变化(图1I)。对C1ql3 KO大鼠从出生到12个月大的存活率进行监测,结果显示C1ql3 KO不影响大鼠的寿命。这些结果表明,C1ql3敲除大鼠成功获得,并且C1ql3敲除不影响生长、发育和存活。
图1 敲除大鼠的建立和鉴定
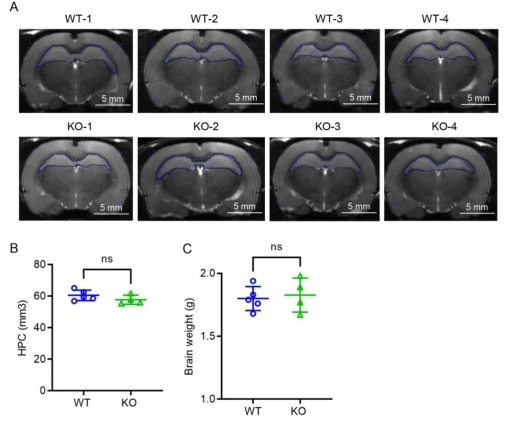
2. C1ql3 敲除不影响大鼠脑结构
MRI评估WT和KO大鼠脑结构变化以及海马体积改变。然后牺牲大鼠,获得整个大脑并称重。如图2结果显示,KO大鼠的海马体积和脑重量与WT大鼠没有显著差异。
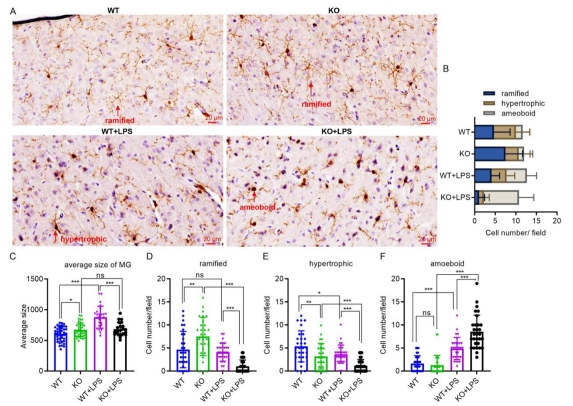
图2 MRI检查敲除大鼠脑结构改变 3. C1ql3 敲除影响小胶质细胞活化
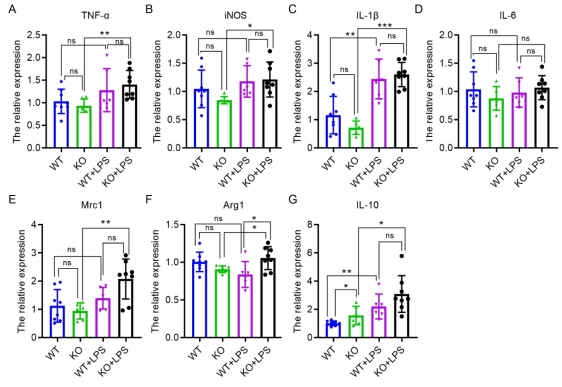
Iba1阳性小胶质细胞的结果分析显示,KO脑中的小胶质细胞总数与WT脑中的没有差异(图3B)。然而,KO脑中分支小胶质细胞的数量显著增加了40%(图3D),肥大的小胶质细胞与WT脑相比显著减少了35%(图3E)。KO脑中小胶质细胞的平均大小也与WT脑相比较呈增加趋势(图3C)。这些结果表明C1ql3的缺失影响了小胶质细胞的形态,反映了C1ql3 KO诱导的小胶质细胞活化状态的改变。然而,尽管小胶质细胞的形态受到C1ql3缺失的影响,但与WT脑相比,KO脑中TNF-α、iNOS、IL-1β、IL-6、Mrc1和Arg1的表达并没有变化(图4A-F)。与WT脑相比,KO脑中只有抗炎因子IL-10的水平增加了55%(图4G)。这些结果表明,C1ql3 KO可能与小胶质细胞M2极化呈正相关,这与最近的一项研究结果一致。 为了进一步探讨炎症条件下C1ql3 KO对小胶质细胞的影响,我们将对照大鼠和KO大鼠进行LPS腹腔注射,一周后解剖大脑并行冠状切片。免疫组化结果显示,在LPS刺激条件下,KO脑中分支型小胶质细胞和肥大型小胶质细胞的数量分别显著减少74%和68%(图3D,E),而与WT脑相比,KO大脑中的阿米巴样小胶质细胞显著增加74%(图3F)。LPS刺激的KO脑中TNF-α、iNOS、IL-1β、IL-6、Mrc1和IL-10的表达与LPS刺激的WT脑没有差异(图4A-E,G),而抗炎因子Arg1的水平与WT脑相比显著增加了16%(图4F)。 LPS刺激后,WT和KO小胶质细胞均被LPS激活,表现为阿米巴类型小胶质细胞增多和炎症因子表达增加,如IL-1β(图4)。值得注意的是,LPS诱导的KO小胶质细胞的激活程度似乎比WT小胶质细胞更高,表现为与WT+LPS小胶质细胞相比,KO+LPS小神经胶质细胞中的阿米巴型和抗炎因子Arg-1表达增加(图4)。 总之,这些结果表明,C1ql3 KO在没有病理刺激的情况下具有更高的IL-10水平,显示出增加的抗炎活性,而在LPS刺激条件下促进小胶质细胞阿米巴样极化和抗炎活性增加。
图3 免疫组化染色观察敲除大鼠脑小胶质细胞形态变化
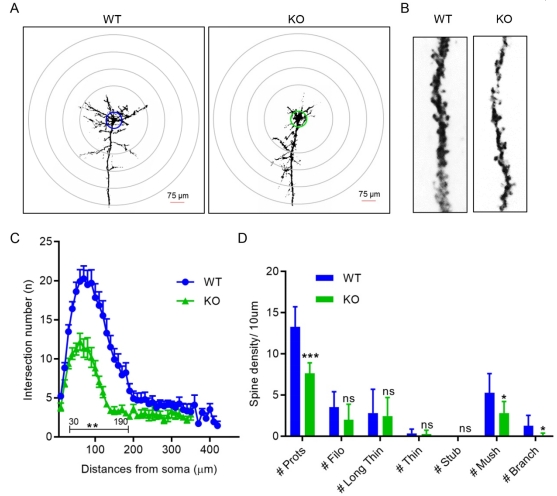
图4敲除大鼠脑小胶质细胞中炎症因子和抗炎因子的表达 4. C1ql3 敲除导致神经元分支和树突棘减少
高尔基染色评价皮层中的神经元复杂性和树突棘改变。Sholl分析显示,与WT神经元相比,KO神经元的分支显著减少(图5A,C)。这一结果表明C1ql3 KO损伤了神经元的复杂性。树突棘统计结果显示,KO神经元的树突棘总数显著减少(图5B,D),特别是与WT神经元相比,KO神经元上的蘑菇型树突棘和分支型树突棘显著减少(图5B,D)。KO大鼠脑中树突分支的减少和棘密度的降低表明C1ql3敲除损害了神经元的完整性。
图5 高尔基染色观察敲除大鼠脑神经元结构变化 5. C1ql3 敲除大鼠发生行为异常
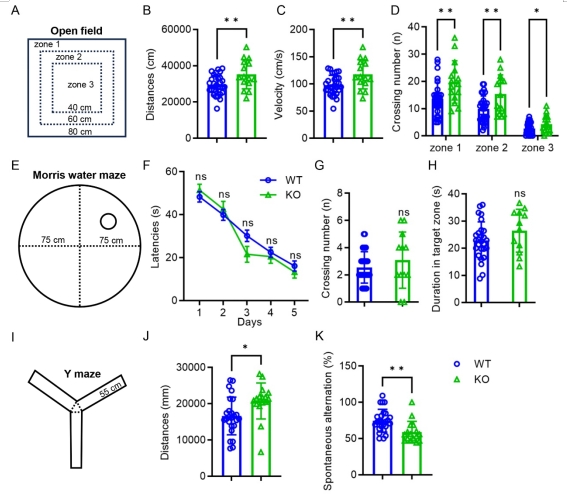
采用开放旷场实验、Morris水迷宫和Y迷宫实验对动物进行行为学评价。开放旷场实验表明,KO大鼠过度活跃,运动总路程增加,移动速度增加,穿越区域的频率增加(图6 A-D)。在Morris水迷宫中,与WT大鼠相比,KO大鼠没有发现明显的认知缺陷(图6 E-H)。然而,在Y迷宫中,观察到KO大鼠的短时工作记忆受损,表现为与WT大鼠相比,自发交替率显著减少(图6I-K)。结果表明,C1ql3 敲除影响大鼠的自主运动并损伤短时工作记忆。
图6行为学检测C1ql3 敲除大鼠的运动和认知改变 |
| 动物模型的评价与验证 | 1 动物模型基因型鉴定 C1ql3敲除大鼠的基因型检测引物包括两个上游引物: 5’- TCCAAAAGCAGACAAGAGGATC -3’和5’- CTACTTCTTCACCTACCACGTCCTG-3’以及一个下游引物 5’-GGCTTCTGAAACCTTATACATTCTCG-3’. 2 WB评价该基因在敲除大鼠的蛋白表达水平 提取仔代大鼠大脑组织总蛋白,进行免疫印迹,确认C1ql3在脑组织蛋白中表达缺失。 3 生存率情况 对C1ql3 KO大鼠从出生到12个月大的存活率进行监测,结果显示C1ql3 KO不影响大鼠的寿命。 4大脑形态解剖观察 MRI和解剖观察均显示,KO大鼠的海马体积和脑重量与WT大鼠没有显著差异。 5 行为学测试 开放旷场实验中,KO大鼠表现为自主活动增加。Y迷宫中,观察到KO大鼠自发交替率显著减少。C1ql3 敲除影响大鼠的自主运动并损伤短时工作记忆。 |
| 保存方式 | 活体 |
| 合作方式 | 不限定 |
| 相关文章 | C1ql3 knockout affects microglia activation, neuronal integrity, and spontaneous behavior in Wistar rats(Animal Models and Experimental Medicine, 2024,accept) |
| 备注 |


 京公网安备 11010502043083号
京公网安备 11010502043083号