| 标识符 | CSTR:16397.09.0H01001445 |
|---|---|
| 资源中文名称 | TSPO KO-APP/PS1小鼠模型 |
| 资源英文名称 | TSPO KO-APPswe/PSEN1dE9(APP/PS1)mice model |
| 疾病概述 | 阿尔茨海默病(Alzheimer’s disease,AD)是最常见的因脑部退行性病变而引起进行性痴呆症的神经退行性疾病,逐渐成为严重影响老年人健康的疾病之一。AD的临床症状包括进行性记忆减退、行动能力受损和日常活动困难;AD的早期症状为思维和行为无意识的改变、对新信息的记忆障碍以及语言的功能障碍性改变;AD的主要病理特征包括脑组织中Aβ斑块沉积和细胞内神经原纤维缠结,其次还有胶质细胞活化和神经元死亡,并伴有炎症和突触改变等病理发生。越来越多的证据证明神经炎症在AD的发生发展中发挥着重要的作用。 目前尚无有效的治疗AD的方法,可能因为缺乏明确的致病机制。过去的几十年研究为 Aβ和Tau蛋白的中心作用以及胶质细胞在AD发病机制中的各种分子和细胞途径中的作用提供了越来越多的证据。AD的发病机制包括多种成分的致病作用和中枢神经系统内各种细胞类型的行为改变。尽管已获得了AD的很多相关理论知识,但是还没有成功开发出有效的治AD的策略。与Aβ沉积相比,Tau蛋白在脑组织中的积累被认为发生的较晚,但AD患者的认知能力下降的关系更密切。基于淀粉样蛋白和Tau蛋白病理学的暂时出现以及Aβ过量产生导致AD的证据,同时越来越多的证据表明神经炎症在AD的发病机制中也起着十分重要的作用。 |
| 实验动物背景信息 | C57BL/6J背景的TSPO KO-APP/PS1小鼠 |
| 模型制作方法 | 实验材料 1.1 实验动物 TSPO KO小鼠由本实验构建及繁殖。AD模型小鼠 APPswe/PSEN1dE9(APP/PS1)小鼠来源于 Jackson Laboratory。 1.2 主要实验仪器 PCR核酸扩增仪(Veriti FAST,Applied Biosystems) 激光共聚焦荧光显微镜(LSM780,Zeiss) 倒置荧光显微镜(DMi8,Leica) 酶标仪 (MULTISKAN FC, Thermo Fisher Scientific) DYY-6C 蛋白电泳仪(六一仪器厂) 凝胶图像分析仪 InGenius (SYNGENE) 台式低温离心机(Heraeus Biofuge Primo R,Thermo Fisher Scientific) 二氧化碳细胞培养箱(Heracell 240i, Thermo Fisher Scientific) 生物安全柜(Herasafe, Thermo Fisher Scientific) 2. 实验操作规程和动物处理伦理 实验动物培养在中国医学科学院基础医学研究所 SPF 级实验动物中心屏障设施内繁殖及饲养。研究中所使用的小鼠实验方法均由中国医学科学院基础医学研究所实验动物管理及伦理委员会审查。 2.1 小鼠合笼繁殖: 将TSPO全身敲除小鼠 与APP/PS1双转基因小鼠结合,使用新生约7日的小鼠进行基因型鉴定,得到 TSPO KO-APP/PS1 小鼠及其同窝对照 TSPO WT-APP/PS1小鼠。 2.2 基因型鉴定 使用TSPO 鉴定引物为 HW007、HW008 和 HW009;APP基因型鉴定引物为 OMIR3610、OMIR3611、OMIR7338和OMIR7339;PSEN1基因型鉴定引物为OMIR1644、OMIR1645、 OMIR7338 和 OMIR7339进行PCR鉴定基因型。引物序列为: 引物HW007 5’ GATGGAGAAACTGAGTCCCAGTCAGGG -3’ 引物HW008 5’ GCTCTGCCCTAATCACAAAGTTTCACAC -3’ 引物HW009 5’ TTAAGGAGAGGTTTTGTCCTTGTGTC -3’ 引物OMIR3610 5’ AGGACTGACCACTCGACCAG -3’ 引物OMIR3611 5’ CGGGGGTCTAGTTCTGCAT -3’ 引物OMIR7338 5’ CTAGGCCACAGAATTGAAAGATCT -3’ 引物OMIR7339 5’ GTAGGTGGAAATTCTAGCATCATCC -3’ 引物OMIR1644 5’ AATAGAGAACGGCAGGAGCA -3’ 引物OMIR1645 5’ GCCATGAGGGCACTAATCAT -3’ |
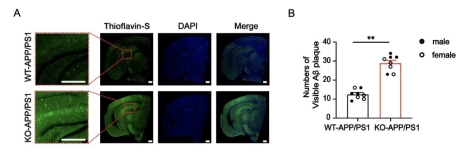
| 模型表型数据 | 1. TSPO KO-APP/PS1小鼠脑组织Aβ沉积增多 为了研究Aβ病理过程中TSPO的作用,我们采用APP/PS1双转基因小鼠作为AD模型小鼠,将实验室前期已建立的TSPO全身敲除小鼠与APP/PS1双转基因小鼠结合,得到 TSPO KO-APP/PS1小鼠及其同窝对照 TSPO WT-APP/PS1小鼠,然后检测脑组织中Aβ聚集沉积情况。免疫组化技术检测结果表明, 相对于TSPO WT-APP/PS1小鼠,TSPO KO-APP/PS1小鼠的脑组织海马区和皮层区均出现更多的Aβ斑块沉积(图 1)。 同时通过硫磺素-S 染色以标记Aβ肽,定性及定量分析结果发现,TSPO敲除后,脑组织中出现更多的Aβ沉积(图2)。
图1 TSPO KO-APP/PS1小鼠脑组织中的Aβ斑块沉积和分布情况
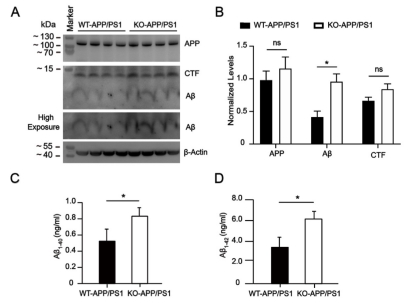
图2 TSPO KO-APP/PS1小鼠脑组织中Aβ沉积情况 2. TSPO KO-APP/PS1小鼠脑组织Aβ含量增多 我们通过免疫印迹技术和酶联免疫吸附试验,检测TSPO KO-APP/PS1小鼠及其同窝对照小鼠脑组织中的Aβ沉积情况,结果发现TSPO基因敲除后小鼠脑中的Aβ沉积增多(图3)。
图3 TSPO KO-APP/PS1小鼠脑组织中Aβ的含量 3. TSPO KO-APP/PS1小鼠脑组织中的Aβ代谢相关的酶表达水平没有差异 由于TSPO基因敲除后导致小鼠体内Aβ沉积增多,我们推测其机制是否由于TSPO缺失影响了Aβ肽的生成,于是我们检测了一些与Aβ生成代谢相关的酶的活性。 首先通过免疫印迹技术检测5月龄TSPO KO-APP/PS1小鼠脑组织中的Aβ代谢相关的酶的活性,结果表明相对于同窝对照小鼠,脑组织中的β-分泌酶1、胰岛素降解酶和中性内肽酶表达水平无差别,这表明TSPO 缺失不会影响Aβ的生成过程(图 4)。
图4 TSPO KO-APP/PS1小鼠脑组织中Aβ代谢相关酶活性表达水平 4 TSPO 缺失影响小胶质细胞的吞噬功能 由于TSPO 缺失不影响Aβ的生成过程,我们推测是否由于小胶质细胞吞噬清除Aβ的作用被抑制,从而导致Aβ沉积增多。所以我们进一步分离了TSPO敲除小鼠及其同窝对照小鼠的原代小胶质细胞,并与荧光标记的Aβ肽共培养后,通过共聚焦显微镜进行观察,结果发现无论是否通过LPS刺激,TSPO敲除的原代小胶质细胞对Aβ肽的吞噬能力明显降低;而且酶联免疫吸附试验发现,相对于对照组,TSPO敲除原代小胶质细胞吞噬Aβ的能力明显下降(图5)。
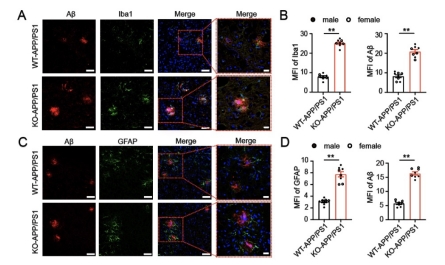
图5 TSPO敲除小鼠的原代小胶质细胞对Aβ的吞噬能力 5. TSPO KO-APP/PS1小鼠脑组织中海马及皮层区均有更多活化的小胶质细胞 通过免疫组织化学技术检测,定性及定量分析结果发现,相对于同窝对照TSPO WT-APP/PS1 小鼠,TSPO KO-APP/PS1小鼠脑组织中,活化的小胶质细胞明显增多 (图 6)。
图6 TSPO KO-APP/PS1小鼠脑组织中的小胶质细胞活化情况 6. TSPO KO-APP/PS1小鼠脑组织中,活化的小胶质细胞和星型胶质细胞增多,且Aβ斑块沉积增多 通过免疫荧光技术检测发现,TSPO KO-APP/PS1小鼠脑中,在Aβ沉积周围有更多活化的小胶质细胞和星型胶质细胞,且Aβ斑块沉积增多(图7)。
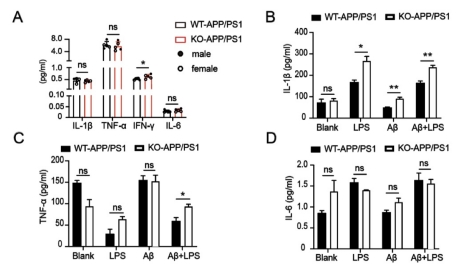
图7 TSPO KO-APP/PS1小鼠脑组织中的小胶质细胞及星型胶质细胞的活化情况 7. TSPO KO-APP/PS1小鼠脑组织中存在更多的炎性因子 我们通过酶联免疫吸附试验检测TSPO 敲除小鼠的脑组织中的炎症相关的细胞因子水平,结果发现TSPO敲除后,细胞因子IFN-γ的产生增多;进一步,我们体外分离TSPO敲除小鼠的原代小胶质细胞,使用Aβ肽刺激后,检测其炎症相关的细胞因子水平,结果发现 TSPO 敲除后可以产生更多的TNF-α 和IL-1β(图8)。
图8 小鼠脑组织或原代小胶质细胞产生的炎性相关细胞因子水平 |
| 动物模型的评价与验证 | 动物模型基因型鉴定 使用TSPO 鉴定引物为HW007、HW008 和HW009;APP基因型鉴定引物为OMIR3610、OMIR3611、OMIR7338和OMIR7339;PSEN1基因型鉴定引物为OMIR1644、OMIR1645、OMIR7338和OMIR7339进行PCR鉴定基因型。 |
| 保存方式 | 活体 |
| 合作方式 | 仅限合作研究 |
| 相关文章 | Zhang H, Wang H, Gao F, Yang J, Xu Y, Fu Y, Cai M, Zhang X, Yang Q, Tong K, Hu Y, Chen H, Ma C, He W, Zhang J. TSPO deficiency accelerates amyloid pathology and neuroinflammation by impairing microglial phagocytosis. Neurobiol Aging. 2021 Oct;106:292-303. doi: 10.1016/j.neurobiolaging.2021.06.020. Epub 2021 Jul 3. PMID: 34340010. |
| 备注 |






 京公网安备 11010502043083号
京公网安备 11010502043083号