| 标识符 | CSTR:16397.09.0C16001442 |
|---|---|
| 资源中文名称 | 新冠变异株Delta感染恒河猴模型 |
| 资源英文名称 | SARS-CoV-2 Delta strain infected Rhesus macaques model |
| 疾病概述 | 新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19),简称“新冠肺炎”,是新型冠状病毒(SARS-CoV-2)感染引起的急性呼吸道传染病,可导致急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)、感染性休克、多器官的衰竭,甚至死亡。新冠疫情的爆发给全球人民的健康及经济发展都带来了巨大的威胁,被世界卫生组织定义为“国际关注的突发公共卫生事件”。随着SARS-CoV-2在全球的流行,产生了很多变异株,世界卫生组织(WHO)建立了遗传变异分类系统,将新冠病毒的变异株分成了两类,分别是“关切变异株”(Variants of Concern,VOCs)和需关注的变异株(Variants of Interest,VOIs) 。VOCs 意味着病毒已传染至多国,传染性和严重程度已经被证实或疑似存在显著影响。WHO 将 Alpha (B.1.1.7)、Beta (B.1.351)、Gamma (P.1)、Delta(B.1.617.2)和 Omicron(B.1.1.529)变异株定义为 VOCs。 最早在 2020 年 10 月于印度发现 Delta 变异株(B.1.617.2)。其 S 蛋白关键突变位点有 T478K、L452R 、D614G 和 P681R 等。其中 681 位氨基酸突变也在 Alpha 变异株中发现,681 氨基酸残基位于 S 蛋白 Furin 酶切位点附近,P681R取代提高了S1-S2切割效率,增加了病毒对宿主细胞的吸附及融合的能力,从而导致传播率增加65%。感染Delta的患者病情更严重,死亡率更高,已被证明P681R突变是导致Delta变异株致病力增加的原因。Delta传染性比以往任何新冠变异毒株都高,比 Alpha 高 50%,同时也是原始新冠病毒的两倍。 |
| 实验动物背景信息 | 实验用恒河猴在实验室内传代三次以上,遗传背景明确,年龄为1-3岁。实验前进行血清学检查证明抗SARS-CoV-2抗体阴性。恒河猴在生物安全三级(BSL-3)实验室内饲养,并按国家动物生物安全标准操作规程进行操作。 |
| 模型制作方法 | 实验材料 1.1 SARS-CoV-2(Delta毒株),由中国医学科学院医学实验动物研究所提供。 1.2 实验动物 选用SPF级1-3岁恒河猴,2.5-3.5kg,来自中国医学科学院医学实验动物研究所(IACUC 批准号:DW21007) 1.3实验环境 所有涉及的病毒实验操作全部在中国医学科学院医学实验动物研究所ABSL-3实验室完成,该实验室已经具备相关实验室和福利伦理资质。 1.4病原培养鉴定 将新型冠状病毒接种到Vero细胞进行分离和储存。Vero细胞培养在DMEM(英潍捷基, 美国)添加10%胎牛血清,100 IU/ml 青霉素和100 μg/ml链霉素的培养基中,环境为37°C,5%CO2。新型冠状病毒的病毒滴度用标准的半数细胞感染率(a standard 50% tissue culture infection dose,TCID50)进行分析。 1.5实验操作规程 (1) 感染途径:经气管感染; (2) 感染剂量:1×106 TCID50 只; (3) 感染体积:1ml/只; (4) 对照组:等体积 PBS。 1.6 动物模型分析 (1)症状观察:感染后,每天观察动物一般症状,记录体重和体温等。 (2)病毒载量:定时收集各组动物脏器,进行RNA抽提,利用RT-PCR技术,检测组织中病毒载量。RT-PCR所用的新型冠状病毒引物如下:上游为5’-TCGTTTCGGAAGAGACAGGT-3’ 下游为5’-GCGCAGTAAGGATGGCTAGT-3’。 (3)病毒分离:肺组织在 DMEM 溶液中研磨制备成匀浆,离心分离上清后,接种于Vero细胞分离病毒并观察细胞病变。 (4)病理学观察 用新鲜的组织福尔马林固定,制备石蜡切片,用HE,免疫组化或荧光染色,镜下观察。 (5)免疫学检测:感染前、感染后收集外周血、淋巴结检测适应性免疫细胞的表达情况,以及血清中特异性抗体。 1.7数据统计处理方法 所有的数据用GraphPad Prism 6.0 软件分析,感染组小鼠和其他对照组小鼠用T 检验方法分析差异,显著性差异用*p ﹤ 0.05, **p﹤0.01 或者 #p﹤0.05, ##p﹤0.01 |
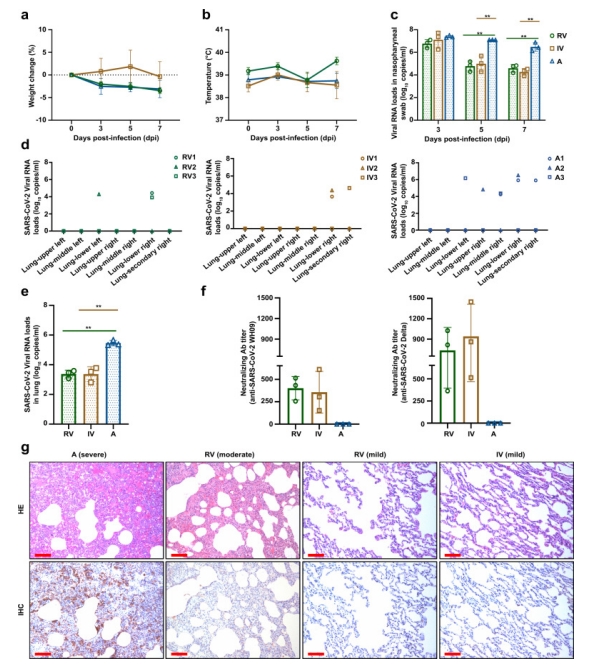
| 模型表型数据 | 1. 体温、体重、病毒载量
感染后指定时间点监测恒河猴体重、体温、鼻咽拭子载量、组织载量及中和抗体滴度等,结果发现加强免疫后恒河猴鼻咽拭子载量在感染后3天后随着时间推移出现大幅度下降,肺组织平均病毒载量显著下降。此外,所有接受同源加强免疫的恒河猴免受SARS-CoV-2 Delta变体的感染,肺组织表现为几乎正常至局灶性和轻度的病理变化,部分接受异源加强免疫的恒河猴免受SARS-CoV-2 Delta的感染,2/3动物表现为轻度肺炎,1/3动物表现为重度肺炎。同时,加强免疫诱导了针对SARS-CoV-2的中和抗体滴度增加,与异源加强免疫相比,同源加强免疫可以迅速召回免疫细胞对SARS-CoV-2的反应。
图1 恒河猴感染Delta后体温、体重、病毒载量及肺组织病理改变。a-b为体温、体重变化;c恒河猴鼻咽拭子载量;d-e组织载量;f中和抗体滴度;g肺组织病理改变 2. 中和抗体变化情况
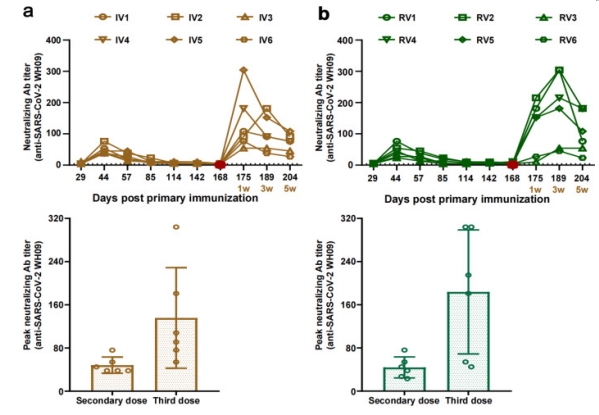
恒河猴在0、29天通过肌肉注射灭活疫苗,初次免疫后168天进行加强免疫,分为同源免疫(第三针为灭活疫苗)和异源免疫(第三针为重组蛋白疫苗),加强免疫后监测恒河猴外周血中和抗体水平,发现同源免疫后一周针对原始毒株及Delta变异株的中和抗体水平达到峰值,异源免疫三周对不同毒株的中和抗体水平达到峰值。
图2 序贯免疫的恒河猴感染Delta前后中和抗体滴度纵向追踪 3. 免疫学检测结果
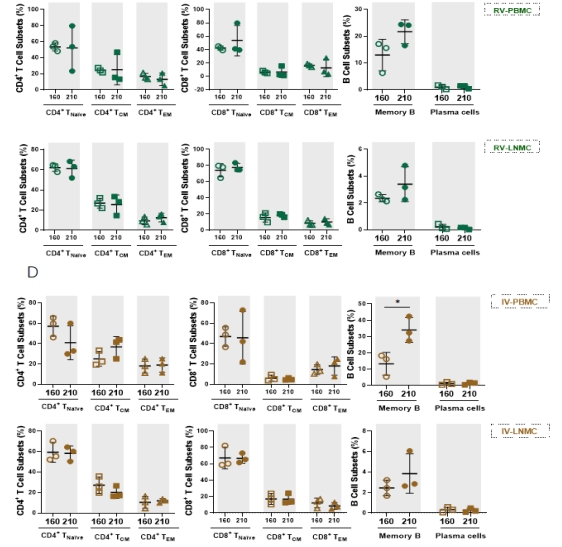
加强免疫前7天及免疫后42天,收集外周血及淋巴结,比较分析加强免疫前后T细胞(包括幼稚 T细胞、中央记忆型T细胞、效应记忆型T细胞)和B细胞比例,结果发现异源免疫加强前后T细胞比例、B细胞及浆细胞比例无明显差别。然而,同源免疫加强后(即灭活疫苗加强)记忆B细胞比例明显增加,相比异源免疫组记忆B细胞比例也有明显提升,以上结果说明灭活疫苗加强免疫方案可以有效快速召回机体免疫反应。
图3 序贯免疫的恒河猴感染Delta前后适应性细胞变化 |
| 动物模型的评价与验证 | 1、临床表征评价指标体系:体温、体重、肺指数 2、病毒学评价指标体系:病毒载量、中和抗体滴度测定 3、免疫学评价指标体系:免疫细胞比例 4、病理学评价指标体系:HE染色、免疫组化 |
| 保存方式 | 活体 |
| 合作方式 | 仅限合作研究 |
| 相关文章 | Deng W, Lv Q, Li F, Liu J, Song Z, Qi F, Wei Q, Yu P, Liu M, Zhou S, Zhang Y, Gao H, Wang N, Jia Z, Gao K, Liu J, Xiao C, Shang H, Wang X, Bao L, Qin C. Sequential immunizations confer cross-protection against variants of SARS-CoV-2, including Omicron in Rhesus macaques. Signal Transduct Target Ther. 2022 Apr 18;7(1):124. doi: 10.1038/s41392-022-00979-z. PMID: 35436986; PMCID: PMC9014776. |
| 备注 |


 京公网安备 11010502043083号
京公网安备 11010502043083号