| 标识符 | CSTR:16397.09.0C16001441 |
|---|---|
| 资源中文名称 | 新冠变异株Omicron感染恒河猴模型 |
| 资源英文名称 | SARS-CoV-2 Omicron strain infected Rhesus macaques model |
| 疾病概述 | 新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19),简称“新冠肺炎”,是新型冠状病毒(SARS-CoV-2)感染引起的急性呼吸道传染病,可导致急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)、感染性休克、多器官的衰竭,甚至死亡。新冠疫情的爆发给全球人民的健康及经济发展都带来了巨大的威胁,被世界卫生组织定义为“国际关注的突发公共卫生事件”。随着SARS-CoV-2在全球的流行,产生了很多变异株,世界卫生组织(WHO)建立了遗传变异分类系统,将新冠病毒的变异株分成了两类,分别是“关切变异株”(Variants of Concern,VOCs)和需关注的变异株(Variants of Interest,VOIs) 。VOCs 意味着病毒已传染至多国,传染性和严重程度已经被证实或疑似存在显著影响。WHO 将 Alpha (B.1.1.7)、Beta (B.1.351)、Gamma (P.1)、Delta(B.1.617.2)和 Omicron(B.1.1.529)变异株定义为 VOCs。 Omicron变异株是 COVID-19 大流行期间 SARS-CoV-2 变异株中具有最多变异的毒株。奥密克戎变异株的氨基酸突变广泛分布在四种结构蛋白上,包括刺突蛋白(S)、包膜蛋白(E)、膜蛋白(M)、核衣壳蛋白(N)和非结构蛋白(NSPs)(NSP3、NSP4、NSP5、NSP6、NSP12、NSP1)。Omicron变异株刺突蛋白的突变数量是Delta变异株的两倍。其传染性可能比原始病毒高10倍以上,大约是德尔塔病毒的两倍。 |
| 实验动物背景信息 | 实验用恒河猴在实验室内传代三次以上,遗传背景明确,年龄为1-3岁。实验前进行血清学检查证明抗SARS-CoV-2抗体阴性。恒河猴在生物安全三级(BSL-3)实验室内饲养,并按国家动物生物安全标准操作规程进行操作。 |
| 模型制作方法 | 实验材料 1.1 SARS-CoV-2(Omicron毒株),由中国医学科学院医学实验动物研究所提供。 1.2 实验动物 选用SPF级1-3岁恒河猴,2.5-3.5kg,来自中国医学科学院医学实验动物研究所(IACUC 批准号:DW21007) 1.3实验环境 所有涉及的病毒实验操作全部在中国医学科学院医学实验动物研究所ABSL-3实验室完成,该实验室已经具备相关实验室和福利伦理资质。 1.4病原培养鉴定 将新型冠状病毒接种到Vero细胞进行分离和储存。Vero细胞培养在DMEM(英潍捷基, 美国)添加10%胎牛血清,100 IU/ml 青霉素和100 μg/ml链霉素的培养基中,环境为37°C,5%CO2。新型冠状病毒的病毒滴度用标准的半数细胞感染率(a standard 50% tissue culture infection dose,TCID50)进行分析。 1.5实验操作规程 (1) 感染途径:经气管感染; (2) 感染剂量:1×106 TCID50 只; (3) 感染体积:1ml/只; (4) 对照组:等体积 PBS。 1.6 动物模型分析 (1)症状观察:感染后,每天观察动物一般症状,记录体重和体温等。 (2)病毒载量:定时收集各组动物脏器,进行RNA抽提,利用RT-PCR技术,检测组织中病毒载量。RT-PCR所用的新型冠状病毒引物如下:上游为5’-TCGTTTCGGAAGAGACAGGT-3’ 下游为5’-GCGCAGTAAGGATGGCTAGT-3’。 (3)病毒分离:肺组织在 DMEM 溶液中研磨制备成匀浆,离心分离上清后,接种于Vero细胞分离病毒并观察细胞病变。 (4)病理学观察 用新鲜的组织福尔马林固定,制备石蜡切片,用HE,免疫组化或荧光染色,镜下观察。 1.7数据统计处理方法 所有的数据用GraphPad Prism 6.0 软件分析,感染组小鼠和其他对照组小鼠用T 检验方法分析差异,显著性差异用*p ﹤ 0.05, **p﹤0.01 或者 #p﹤0.05, ##p﹤0.01 |
| 模型表型数据 | 1. 体温、体重、病毒载量
Omicron感染后恒河猴的体重变化和直肠温度在正常范围内波动。感染后7 dpi时实施安乐死和尸检。收集单个肺叶以估计病毒载量。在模型组猴肺的大部分肺叶中检测到高水平的病毒RNA,范围从104.33到106.49 copies/ml。相比之下,BV组只有一只猴子的下肺出现病毒,病毒拷贝数较低(104.89/ml)。与对照组相比,BV动物肺部平均病毒载量显著降低 (P < 0.05)。Omicron感染后,2/3加强免疫组动物鼻咽拭子载量在感染后5、7天完全清除,平均肺组织病毒载量显著下降。
图1 恒河猴感染Omicron后体温、体重、病毒载量改变 2. 病理学改变
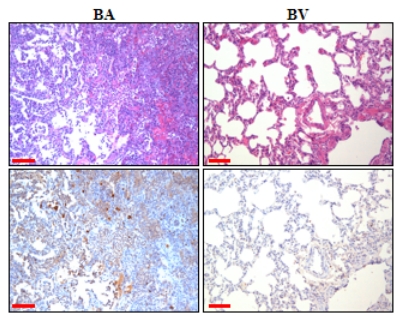
在样本的组织病理学检查中,感染SARS-CoV-2 Omicron变体的猴子出现了与Delta变体相似的弥漫性肺泡损伤,而所有接种过SARS-CoV-2 Omicron变体的猕猴(3/3)在很大程度上受到了保护,表现出几乎正常到局灶性和轻度的组织学病变,没有任何血栓形成、血管炎或血管周围炎。其他组织未见明显异常。免疫组化染色结果与H&E观察结果一致。
图2 恒河猴感染Omicron后不同组病理学改变 |
| 动物模型的评价与验证 | 1、临床表征评价指标体系:体温、体重、肺指数 2、病毒学评价指标体系:病毒载量、中和抗体滴度测定 3、病理学评价指标体系:HE染色、免疫组化 |
| 保存方式 | 活体 |
| 合作方式 | 仅限合作研究 |
| 相关文章 | Deng W, Lv Q, Li F, Liu J, Song Z, Qi F, Wei Q, Yu P, Liu M, Zhou S, Zhang Y, Gao H, Wang N, Jia Z, Gao K, Liu J, Xiao C, Shang H, Wang X, Bao L, Qin C. Sequential immunizations confer cross-protection against variants of SARS-CoV-2, including Omicron in Rhesus macaques. Signal Transduct Target Ther. 2022 Apr 18;7(1):124. doi: 10.1038/s41392-022-00979-z. PMID: 35436986; PMCID: PMC9014776. |
| 备注 |



 京公网安备 11010502043083号
京公网安备 11010502043083号